Etiologia trądziku
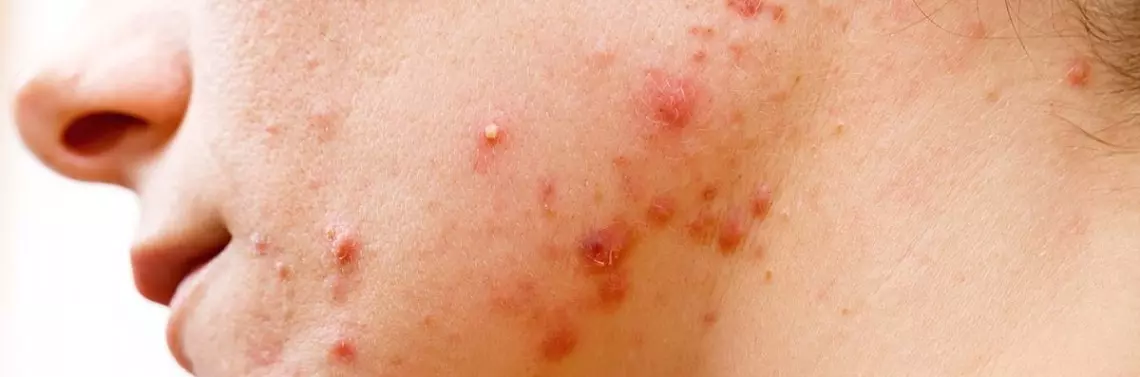
Trądzik pospolity (acne vulgaris) jest przewlekłym schorzeniem zapalnym dotyczącym okolic łojotokowych (głównie: klatka piersiowa, twarz, plecy), charakteryzującym się m.in. obecnością zaskórników (comedones), wykwitów grudkowych, krostkowych, torbieli ropnych oraz blizn [1–3].
Za wybitnie przewlekłym charakterem tego schorzenia przemawia: widoczny wzorzec nawrotów, przedłużony okres występowania choroby, okresy zaostrzeń zmian, powolny początek oraz skutki psychologiczne i społeczne [4].
Etiopatogeneza trądziku jest wieloczynnikowa. U wszystkich chorych występuje: wzmożona produkcja łoju, nadmierne rogowacenie przewodów wyprowadzających i ujść gruczołów łojowych, rozwój flory bakteryjnej, a także uwalnianie mediatorów zapalnych w skórze.
Pierwotnym wykwitem, który zapoczątkowuje kaskadę zmian zapalnych, jest mikrozaskórnik. Mikrozaskórniki mogą tworzyć się pod wpływem różnych czynników, takich jak niedobór kwasu linolenowego, nadmierna sekrecja androgenów lub nadmiar wolnych kwasów tłuszczowych [5]. Czynnikiem warunkującym przekształcenie się mikrozaskórnika w zaskórnik jest keratynizacja wewnątrzmieszkowa, która prawdopodobnie spowodowana jest podrażnieniem ścian mieszka włosowego przez materiał łojowy i bakterie, co prowadzi do nadprodukcji i gromadzenia korneocytów. Zjawisku towarzyszy nadprodukcja tonofilamentów, desmosomów oraz keratyny K6 i K16. Wynikiem tego jest wytworzenie, przy udziale enzymu transglutaminazy, skeratynizowanej koperty. Proces ten powoduje zwężenie kanału wyprowadzającego i utrudnia usuwanie zawartości gruczołu łojowego na powierzchnię skóry. Zjawisko to dotyczy głównie przerośniętych gruczołów łojowych ze szczątkowym włosem w fazie anagenu. W proces keratynizacji zaangażowane są również cytokiny, głównie IL-1, o działaniu prozapalnym [6, 7].
W procesie tworzenia zaskórnika rolę odgrywa również zawartość lipidowa mieszka włosowego. Łój w obrębie gruczołów i przewodów wyprowadzających jest jałowy i nie zawiera wolnych kwasów tłuszczowych. Kolonizacja bakteryjna (zwłaszcza Cutibacterium acnes, dawna nomenklatura Propionibacterium acnes) dzięki odpowiednim enzymom umożliwia hydrolizę składników łoju do wolnych kwasów tłuszczowych o działaniu drażniącym i chemotaktycznym. Wysunięto hipotezę, że to nasilona sekrecja łoju sprzyja niedoborowi kwasu linolowego, co wtórnie nasila komedogenezę [8, 9].
Nadmierna produkcja i gromadzenie łoju oraz zamknięcie ujścia gruczołu łojowego sprzyjają kolonizacji bakteryjnej. Mikrozaskórniki zamieszkuje przede wszystkim maczugowiec beztlenowy – Cutibacterium acnes. Drobnoustrój ten dzięki obecności lipazy hydrolizuje dwu- i triglicerydy łoju do wolnych kwasów tłuszczowych (free fatty acids – FFA). Wolne kwasy tłuszczowe, które powstają w procesie hydrolizy, mają działanie drażniące, prozapalne oraz nasilające rogowacenie przymieszkowe. Działanie prozapalne mają również: hialuronidaza, proteazy i neuraminidazy, produkowane przez C. acnes. Drobnoustrój ten uwalnia także niskocząsteczkowe czynniki chemotaktyczne (peptydy) przyciągające granulocyty obojętnochłonne oraz aktywuje zarówno dopełniacz na drodze alternatywnej, jak i klasyczną odpowiedź immunologiczną [10].
Pod wpływem C. acnes dochodzi także do masywnej produkcji anionów nadtlenkowych przez keratynocyty, które w połączeniu z tlenkiem azotu tworzą peroksynitraty przyczyniające się do rozpadu keratynocytów [8, 11].
Receptor TLR2 (toll-like receptor-2), znajdujący się w monocytach, identyfikuje składniki ścian bakterii Gram-dodatnich, m.in. C. acnes i odgrywa również rolę w stymulacji reakcji zapalnej w przebiegu trądziku. Rodzina receptorów TLR2 pełni podstawową funkcję w systemie immunologicznym skóry, a także w homeostazie i odnowie komórkowej. Znajdują się one na wielu komórkach skóry, takich jak: keratynocyty, melanocyty, fibroblasty, komórki prezentujące antygen. Stymulacja receptorów TLR2 prowadzi przede wszystkim do uruchomienia kaskady cytokin prozapalnych. Receptory te dzielą się na subpopulacje zewnątrz- i wewnątrzkomórkowe. Receptory na powierzchni komórek wykazują przede wszystkim aktywność antybakteryjną, pobudzają aktywność fagocytarną i sygnały pobudzające dojrzewanie komórek. Cząstki wewnątrzkomórkowe rozpoznają głównie wirusy i aktywują geny stymulujące aktywność przeciwwirusową [12].
Chociaż u chorych na trądzik nie wykazano pierwotnych zaburzeń immunologicznych, obserwuje się jednak nadmierną reakcję układu immunologicznego na antygeny C. acnes, wyrażającą się podwyższonym mianem przeciwciał, i nadmiernie nasiloną odpowiedź zapalną...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.