Wprowadzenie
Cyklosporyna (CsA) została wyizolowana w latach 70. XX wieku z geofilnego grzyba Tolypocladium inflatum przez Borela. Działanie leku ma charakter odwracalny i wiąże się z hamowaniem limfocytów T, szczególnie pomocniczych, w mniejszym stopniu supresorowych. Wpływ na limfocyty typu B jest niewielki. Cyklosporyna A we wnętrzu komórki łączy się z białkiem cytozolu, cyklofiliną (CpN), tworząc kompleks o aktywności blokującej zależną od jonów wapnia kalcyneurynę (CaN), co uniemożliwia aktywację czynnika transkrypcyjnego (NF-AT) i wewnątrzjądrową ekspresję genów kodujących cytokiny prozapalne, w tym interleukinę 2 (IL-2), odgrywającą kluczową rolę w wyzwalaniu reakcji zapalnych mediowanych przez limfocyty T, interferon γ oraz czynnik stymulujący kolonie granulocytów i makrofagów. Ponadto cyklosporyna osłabia chemotaksję komórek nacieku zapalnego do skóry oraz znacznie zmniejsza procesy proliferacji keratynocytów i angiogenezy [1–3].
Cyklosporyna A pod względem budowy chemicznej jest małym cyklicznym polipeptydem zbudowanym z 11 aminokwasów. Duża masa cząsteczkowa CsA wynosząca 1203 kDa wpływa na brak zdolności do penetracji przezskórnej, co wiąże się z koniecznością stosowania leku w formie systemowej. Biodostępność po podaniu doustnym wynosi 30–45%, a lipofilny charakter substancji przyczynia się do jej lepszego wchłaniania z przewodu pokarmowego z produktami bogatymi w tłuszcze. Zastosowanie formy dożylnej wymaga trzykrotnego zmniejszenia należnej dawki doustnej. Cyklosporyna A należy do kategorii C, co oznacza, że jej stosowanie w czasie ciąży nie jest zalecane, chyba że potencjalne korzyści dla matki przewyższają potencjalne zagrożenie dla dziecka. Nie udowodniono działania teratogennego leku, jednak może on nasilać ryzyko porodu przedwczesnego. Ponadto kobiety w trakcie terapii inhibitorem kalcyneuryny nie powinny karmić piersią [4–6].
Badania naukowe wykazały silne działanie immunosupresyjne CsA, które wykorzystywane jest w terapii chorób autoimmunologicznych, m.in. reumatoidalnego i łuszczycowego zapalenia stawów oraz łuszczycy [7]. Pierwszy preparat cyklosporyny zaaprobowany przez Agencję Żywności i Leków (Food and Drug Administration – FDA) został dopuszczony do obrotu w 1983 r.
Dla lekarzy dermatologów niewątpliwie istotny był 1997 r., kiedy CsA uzyskała rejestrację do leczenia ciężkiej łuszczycy [8]. Obecnie zgodnie ze wskazaniami rejestracyjnymi CsA stanowi opcję terapeutyczną w leczeniu umiarkowanej do ciężkiej łuszczycy plackowatej oraz w ciężkim atopowym zapaleniu skóry u osób dorosłych.Należy podkreślić, że terapia CsA powinna być prowadzona przez lekarzy mających odpowiednie doświadczenie w tym zakresie, a każdy pacjent, u którego rozważa się włączenie tego leku, wymaga właściwego przygotowania i przestrzegania zaleceń lekarskich. Z uwagi na ryzyko wystąpienia wielu działań niepożądanych (tab. 1.) [9]
w trakcie leczenia konieczne jest przeprowadzanie regularnych kontroli klinicznych i laboratoryjnych. Długoterminowe leczenie chorób autoimmunologicznych o przewlekłym przebiegu wiąże się z ryzykiem rozwoju zaburzenia czynności nerek [10]. Metabolizm wątrobowy CsA przebiegający z udziałem cytochromu P450 wpływa na wystąpienie możliwych interakcji lekowych (tab. 2.), co w efekcie może nasilać lub osłabiać działanie leku. Warto wspomnieć, że wysokie dawki kumulacyjne promieniowania ultrafioletowego oraz radioterapia mogą nasilać kancerogenność cyklosporyny [11].
W pracy przedstawiono możliwości zastosowania CsA w leczeniu chorób autoimmunologicznych skóry.
POLECAMY
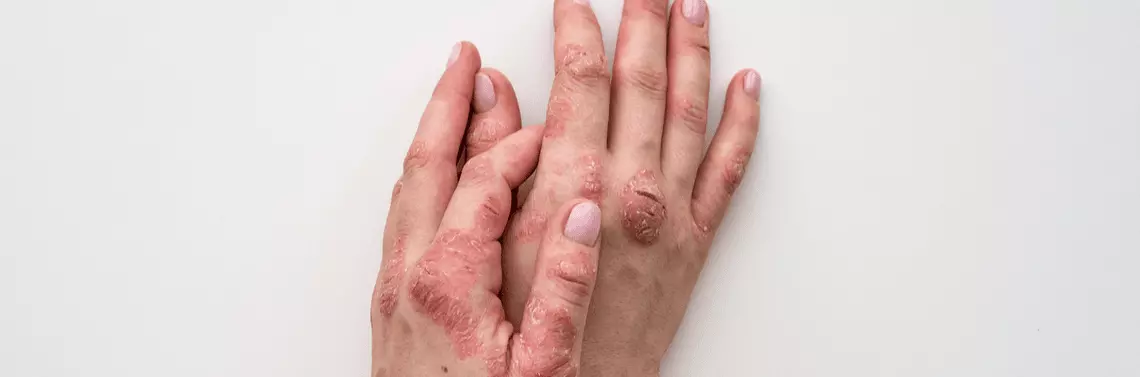
Łuszczyca
Łuszczyca należy do grupy chorób autoimmunologicznych. Wskazują na to zaburzenia immunologiczne, odgrywające istotną rolę w jej patogenezie oraz współistnienie innych chorób z tej grupy, najczęściej łuszczycowego zapalenia stawów [12]. Zgodnie z rekomendacjami Polskiego Towarzystwa Dermatologicznego [13] cyklosporyna jest, obok metotreksatu (MTX) i acytretyny, zalecana w terapii umiarkowanej i ciężkiej łuszczycy plackowatej. Zalecana dawka początkowa mieści się w zakresie 2,5–5 mg/ kg m.c./dobę (minimum 3 mg/kg m.c./dobę to wymagana dawka do programów lekowych NFZ), a okres trwania leczenia nie powinien przekraczać 3–6 miesięcy w terapii interwencyjnej. Cyklosporyna powinna być włączana jedynie w celu indukcji remisji zmian chorobowych, a dłuższy okres leczenia, przekraczający 2 lata, z uwagi na ryzyko wystąpienia działań niepożądanych wymaga szczególnej ostrożności [14].
Niewątpliwą zaletą CsA w leczeniu zmian łuszczycowych jest szybki początek działania leku, co pozwala na uzyskanie istotnej poprawy klinicznej, wyrażonej wskaźnikiem PASI50, po upływie ok. 4–6 tygodni od momentu włączenia leku. Maksymalny efekt terapeutyczny cyklosporyny rozwija się średnio po 5–12 tygodniach leczenia. Wykazano, że skuteczność działania leku koreluje z zastosowaną dawką, co równocześnie zwiększa ryzyko wystąpienia działań niepożądanych. W przypadku dawkowania 5 mg/kg m.c./dobę ustąpienie zmian chorobowych można zaobserwować już po około miesiącu [15, 16].
Kolejną zaletą CsA w leczeniu ciężkiej łuszczycy jest możliwość prowadzenia terapii skojarzonej lub rotacyjnej z innymi preparatami przeciwłuszczycowymi, co pozwala ograniczyć ryzyko wystąpienia działań niepożądanych, zwłaszcza nadciśnienia tętniczego oraz nefrotoksyczności. Choi i wsp. [17] wykazali, że początkowe włączenie cyklosporyny umożliwia osiągnięcie remisji choroby, a zmiana leku na metotreksat (MTX) nie tylko pozwala ją utrzymać, ale prowadzi także do zmniejszenia prawdopodobieństwa wystą...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.