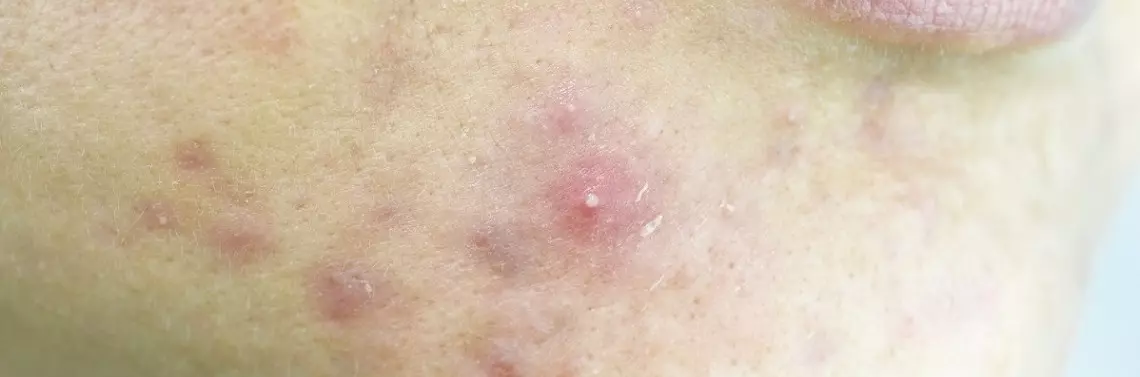
Trądzik pospolity (acne vulgaris) to przewlekła choroba zapalna jednostek włosowo-łojowych, która klinicznie charakteryzuje się obecnością wykwitów niezapalnych (zaskórników otwartych i zamkniętych) oraz zapalnych (grudek i krost) – z różnym nasileniem bliznowacenia oraz zazwyczaj wzmożonym wydzielaniem łoju [1]. Mechanizmy patofizjologiczne tej jednostki chorobowej polegają na hiperproliferacji komórek ujścia mieszka włosowego, tworzeniu się w jego obrębie mikrozaskórnika, nadprodukcji i gromadzeniu się wydzieliny łojowej w obrębie mieszka, co stwarza warunki dla namnażania się bakterii z gatunku Propionibacterium acnes oraz tworzenia się stanu zapalnego przy udziale czynników chemotaktycznych i komórek układu immunologicznego [1, 2]. W ostatnich latach zwrócono uwagę na wyższość procesów zapalnych w tworzeniu się wykwitów pierwotnych nad pozostałymi opisanymi wyżej zjawiskami [3–5].
Ze względu na występowanie zmian na skórze twarzy i fakt, że schorzenie dotyczy najczęściej osób młodych – często nastoletnich – podkreśla się, że trądzik wywiera duży wpływ na psychikę osób dotkniętych tą chorobą. Trądzik może negatywnie wpływać na jakość życia i samoocenę chorych, a także zwiększa u nich ryzyko wystąpienia depresji i lęku. Choroba sprawia, że młoda osoba różni się od swoich rówieśników, co często jest powodem jej wiktymizacji. Jednocześnie podkreśla się, że trądzik coraz częściej występuje u osób dorosłych, utrzymując się nawet do czwartej dekady życia lub przez całe życie [6–8].
POLECAMY
Epidemiologia
W praktyce klinicznej trądzik pospolity jest jedną z najczęściej spotykanych chorób skóry. Pojawia się w okresie pokwitania i dotyczy głównie osób młodych. Występuje u ok. 80% osób w wieku 11–30 lat, a u blisko 100% w wieku 15–17 lat – w tym jako umiarkowany bądź ciężki w 15–20% przypadków. Coraz więcej badań epidemiologicznych podaje dane dotyczące występowania choroby wśród populacji osób dorosłych – 64% w przedziale wiekowym 20–29 lat oraz 43% wśród osób w wieku 30–39 lat. Ponadto 3% mężczyzn i 5% kobiet wykazuje średnio nasilone zmiany trądzikowe powyżej 40. roku życia [9]. Oszacowanie częstości występowania trądziku pospolitego nie jest łatwym zadaniem ze względu na niejednolite definicje choroby, w szczególności dotyczące stopnia jej nasilenia, co sprawia, że dane różnią się w zależności od sposobu i miejsca prowadzenia badań. W populacji światowej szacuje się jego występowanie na 9,4%, co plasuje go wśród dziesięciu najczęściej występujących chorób na świecie. Choć nie istnieje predylekcja występowania co do płci, to jednak – zazwyczaj – cięższe klinicznie postaci obserwuje się u mężczyzn. Prawdopodobnie jest to związane z większym stężeniem androgenów w surowicy krwi osób tej płci. Część analiz epidemiologicznych notuje bardziej powszechne występowanie tej choroby u ludzi zamieszkujących kraje wysokorozwinięte i wśród przedstawicieli rasy kaukaskiej. U czarnoskórych pacjentów częściej obserwuje się specyficzne postaci trądziku – jak trądzik kosmetyczny – oraz powstawanie trwałych przebarwień pozapalnych [1, 2, 7].
Etiopatogeneza
Zidentyfikowanych czynników etiologicznych, warunkujących wystąpienie trądziku pospolitego, jest wiele. Klasyczny pogląd na proces powstawania wykwitów chorobowych przedstawia zapoczątkowanie zmian przez hiperproliferację komórek nabłonka wyściełających ujścia mieszków włosowych i ich złuszczanie do wnętrza kanału mieszka – jest to tzw. keratynizacja wewnątrzmieszkowa – co powoduje formowanie się mikrozaskórników blokujących ujście mieszka. Stworzone warunki sprzyjają kolonizacji bakteryjnej w gruczołach łojowych przez maczugowce beztlenowe z gatunku Cutibacterium acnes (poprzednie nazewnictwo: Propionibacterium acnes). Drobnoustroje te wytwarzają czynniki prozapalne w postaci enzymów modyfikujących skład wydzieliny łojowej oraz czynniki chemotaktyczne dla komórek układu immunologicznego wytwarzających liczne cytokiny prozapalne, ponadto aktywują dopełniacz i wrodzoną odpowiedź immunologiczną typu komórkowego poprzez receptory TLR (toll-like receptor) [3, 10].
Hiperkeratynizacja wewnątrzmieszkowa
Mikrozaskórnik – będący wykwitem pierwotnym trądziku – to niewidoczny gołym okiem mieszek włosowy z ujściem zablokowanym przeszkodą uniemożliwiającą odpływ wydzieliny łojowej na powierzchnię skóry. Jest efektem wewnątrzmieszkowej hiperproliferacji i hiperkeratynizacji komórek wyściełających wnętrze jednostek włosowo-łojowych [11].
Pełna etiologia hiperkeratynizacji wewnątrzmieszkowej nie jest do końca poznana.
Prawdopodobną przyczyną jest działanie drażniące składników łoju oraz czynników bakteryjnych na ściany mieszka włosowego, niedobór kwasu linolowego oraz nadmierne stężenie androgenów zaburzające prawidłową keratynizację komórek. Nasilenie keratynizacji obserwuje się pod wpływem czynników prozapalnych, takich jak interleukina-1 (IL-1), która na drodze autokrynnej pobudza keratynocyty, indukując ekspresję keratyny K16, będącej markerem proliferacji keratynocytów [4, 12]. Na zwiększenie stężenia prozapalnej IL-1 mają ponadto wpływ aktywność P. acnes przez pobudzanie receptorów TLR oraz czynnik transkrypcyjny stymulowany oksydacją skwalenu, wchodzącego w skład wydzieliny łojowej gruczołów łojowych (ryc. 1) [5, 13].

Gruczoły łojowe i łój
Gruczoły łojowe to wytwory naskórka zbudowane ze specyficznie zmodyfikowanych keratynocytów – sebocytów. Mają one budowę zrazikową i są ściśle związane z mieszkami włosowymi, współtworząc wraz z nimi funkcjonalne jednostki włosowo-łojowe. Największe nagromadzenie gruczołów obserwuje się na twarzy, owłosionej skórze głowy, górnej części pleców i klatki piersiowej, gdzie znajdują się mieszki łojowe, tzn. duże gruczoły łojowe z włosem średniej wielkości. Ta lokalizacja tłumaczy predyspozycję do tworzenia się wykwitów trądzikowych w tych określonych częściach ciała. Aktywność wydzielnicza gruczołów zależy do wielu czynników, takich jak: wiek, płeć, gospodarka hormonalna, a także stężenie witaminy D3 [14, 15].
Łój (sebum), produkowany przez sebocyty, to substancja składająca się z triglicerydów i wolnych kwasów tłuszczowych (57%), skwalenu (12%), wosku i estrów steroli (29%) oraz wolnych steroli (ok. 2%). Jego obecność warunkuje prawidłowe utrzymanie i funkcjonowanie bariery naskórkowej, nawilżanie powierzchni skóry i działanie przeciwbakteryjne [7, 16, 17].
Choć wzrost produkcji wydzieliny łojowej jest cechą charakterystyczną dla obrazu patofizjologicznego i klinicznego trądziku pospolitego, to nie jest on warunkiem koniecznym do powstania wykwitów. Jednak większość pacjentów z trądzikiem wykazuje cechy łojotoku, a jego poziom koreluje z nasileniem choroby [7, 18]. Znaczenie ma skład lipidów tworzących sebum. Na skórze pacjentów z trądzikiem występuje zmniejszone stężenie kwasu linolowego, który zapobiega tworzeniu się zaskórników, przy jednoczesnym zwiększonym stężeniu skwalenu, którego oksydacja prowadzi do pobudzenia keratynocytów do produkcji cytokin prozapalnych. Z kolei enzymy C. acnes rozszczepiają triglicerydy do wolnych kwasów tłuszczowych zaburzających funkcje proliferacyjne komórek nabłonkowych mieszka [4, 14, 19].
Kolonizacja bakteryjna
Rola bakterii C. acnes w patofizjologii trądziku pospolitego pozostaje kwestią kontrowersyjną, szczególnie że fakt ich obecności uznawany jest za składnik flory fizjologicznej skóry. Ze względu na preferowanie przez nie warunków beztlenowych, bogatych w substancje lipidowe, dominują one we wnętrzu jednostek włosowo-łojowych [4]. Łojotok i rogowacenie mieszkowe sprzyja namnażaniu C. acnes, co skutkuje zwiększeniem stężenia ich metabolitów o bezpośrednim lub pośrednim działaniu prozapalnym.
Na skutek działania czynników prozapalnych, uwalnianych pod wpływem lipaz, hydrolizujących triglicerydy, a także proteaz, uszkadzających ścianę mieszka, C. acnes stymuluje rozwój odpowiedzi immunologicznej oraz stanu zapalnego, wyzwalając czynniki chemotaktyczne. W zajętym obszarze jako pierwsze pojawiają się limfocyty CD4, a potem neutrofile i monocyty [20]. Dodatkowo drobnoustrój ten poprzez receptory TLR2 i TLR4, obecne na keratynocytach i komórkach zapa...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.