Wprowadzenie
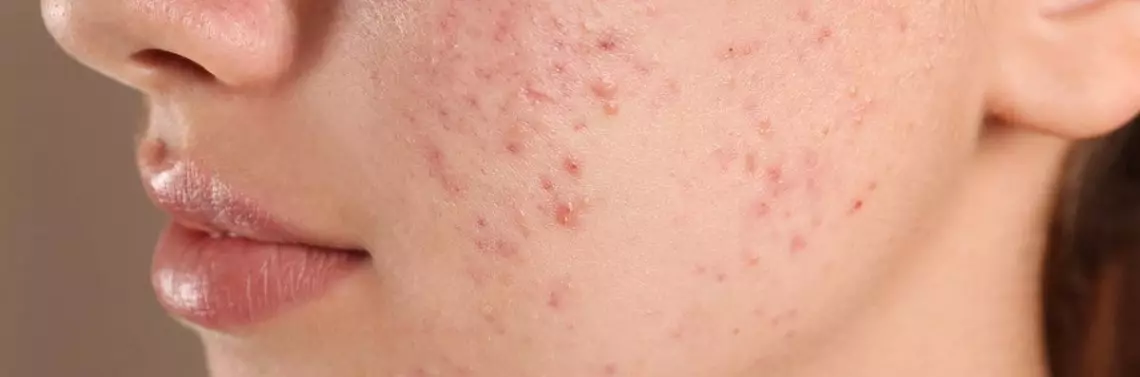
Trądzik (acne) to zapalna choroba jednostki włosowo-łojowej. W obrazie klinicznym choroby obserwuje się wykwity niezapalne – zaskórniki oraz zapalne – grudki, krostki, nacieki zapalne, a ich dominująca liczba decyduje o postaci choroby, odpowiednio zaskórnikowej, grudkowo-krostkowej, ropowiczej, bliznowcowej [1]. Zgodnie z danymi Global Burden of Disease Study z 2010 r. jest to ósma pod względem częstości występowania dermatoza na świecie, która dotyczy ok. 9% populacji ogólnej [2]. Częstość ta waha się w różnych granicach. W przypadku nastolatków wynosi od 35 do 100%. W okresie przedpokwitaniowym, późnego wieku nastoletniego oraz młodej dorosłości stwierdza się zmniejszoną częstość występowania acne. Wraz z wiekiem obserwuje się tendencję spadkową pod względem liczby zachorowań [3]. Podkreśla się, że oprócz czynników demograficznych na rozwój trądziku wpływają: sposób odżywiania, stosowane leki, warunki pracy zawodowej, zanieczyszczenia powietrza, klimat, czynniki psychospołeczne oraz szeroko rozumiany styl życia [4].
Za kluczowe procesy w rozwoju choroby uznaje się nadmierną produkcję łoju przez gruczoły łojowe, nieprawidłową keratynizację w obrębie ujść mieszków włosowo-łojowych, kolonizację gruczołów łojowych przez Cutibacterium acnes oraz stan zapalny. Nadprodukcja łoju w połączeniu ze zmienionym składem wydzieliny sebocytów prowadzi do proliferacji bakterii C. acnes, tworzenia biofilmu i wyindukowania reakcji zapalnej, a także do komedogenezy, czyli formowania zaskórników [5].
POLECAMY
Hormony a trądzik
Funkcjonowanie jednostek włosowo-łojowych podlega regulacji przez endogenne androgeny, odpowiedzialne głównie za rozwój męskich cech płciowych (andro z greckiego oznacza mężczyznę lub męski). Po raz pierwszy związek hormonów płciowych z trądzikiem opisał w 1941 r. Hamilton, który zaobserwował, że u mężczyzn poddanych kastracji nie występują wykwity trądzikowe [6]. Odpowiedni poziom androgenów jest czynnikiem wyzwalającym acne [7].
W obrębie sebocytów znajdują się receptory dla androgenów (androgen receptors – AR) typu jądrowego, indukowane przez ligand, które po aktywacji działają jako czynniki transkrypcyjne. Głównym agonistą AR jest najsilniejszy naturalny androgen, pochodna testosteronu – 5α-dihydrotestosteron (DHT). DHT pod wpływem 5α-reduktazy powstaje z testosteronu lub w wyniku przekształceń biochemicznych z androstendionu, zwłaszcza u kobiet, lub androsteronu, co ma miejsce w okresie życia płodowego [8, 9]. Patogeneza rozwoju trądziku w okresie dzieciństwa została powiązana...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.