Wprowadzenie
Łuszczyca to przewlekła, niezakaźna choroba o nawrotowym przebiegu, należąca do grupy chorób autoimmunologicznych. W jej patogenezie istotną rolę ogrywają czynniki immunologiczne, genetyczne, epigenetyczne i środowiskowe, takie jak promieniowanie ultrafioletowe, leki, palenie tytoniu, nieprawidłowo zbilansowana dieta, nadmierna masa ciała, stres i infekcje. W przebiegu łuszczycy dochodzi do zajęcia skóry oraz u niektórych pacjentów do rozwoju zaburzeń metabolicznych, sercowo-naczyniowych i/lub stawowych w postaci artropatii seronegatywnej, czyli łuszczycowego zapalenia stawów (ŁZS) [1]. Ponadto choroba może negatywnie wpływać na życie codzienne, upośledzać samoocenę i funkcjonowanie społeczne [2]. Należy podkreślić skróconą długość życia chorych, a także znaczące koszty terapii zarówno dla pacjentów, jak i dla systemu opieki zdrowotnej [3]. Co istotne, w 2014 r. Światowa Organizacja Zdrowia uznała łuszczycę za poważną chorobę niezakaźną oraz podkreśliła potrzebę zrozumienia globalnego obciążenia tą chorobą [4].
POLECAMY
Dane dotyczące liczby zachorowań na łuszczycę w populacji ogólnej są ograniczone, podkreśla się jednak, że tak jak w przypadku patogenezy choroby jej epidemiologia staje się coraz lepiej poznawana. Parisi i wsp. w opracowanym w 2020 r. przeglądzie systematycznym wykazali, że częstość występowania łuszczycy w krajach Europy Środkowej jest wysoka i wynosi 1,83% (od 0,62 do 5,32%) [5]. Ponadto u średnio 30% pacjentów z rozpoznaniem łuszczycy do objawów skórnych dołącza się ŁZS, przy czym u zdecydowanej większości (ok. 70–80% chorych) manifestacje skórne poprzedzają dolegliwości stawowe. Jednakże zapalenie stawów może być pierwszym objawem łuszczycy (15–20% chorych), a w pozostałej grupie pacjentów skóra i stawy podlegają procesom zapalnym w ciągu roku [6]. Powyższe informacje podkreślają globalne znaczenie łuszczycy oraz konieczność podejmowania właściwego, indywidualnego i niekiedy wielospecjalistycznego postępowania diagnostyczno-terapeutycznego.
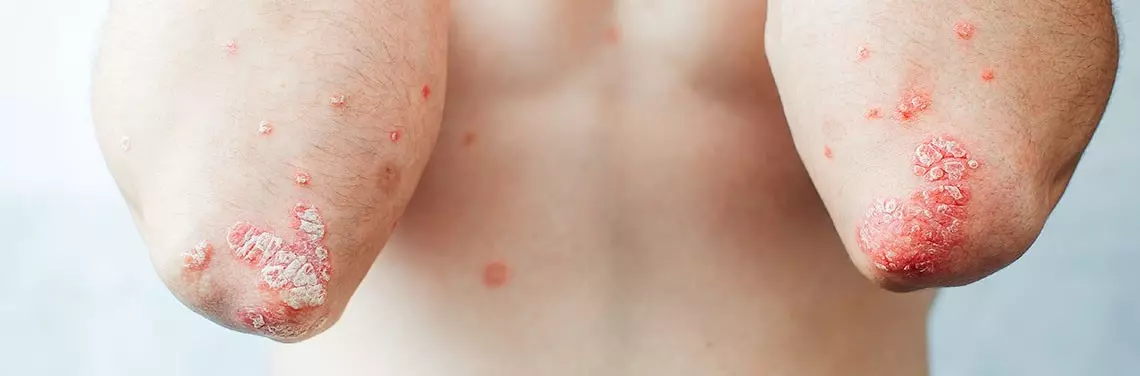
Przebieg kliniczny łuszczycy ma zróżnicowany charakter. Najczęściej na skórze owłosionej głowy, łokci, kolan i okolicy krzyżowej pojawiają się dobrze odgraniczone, rumieniowo-naciekowe ogniska pokryte srebrzystobiałą łuską. Zmiany chorobowe mogą być zlokalizowane na skórze twarzy, w okolicy fałdów, narządów płciowych, dłoni, stóp, aparatu paznokciowego, a nawet całego ciała (erytrodermia).
Do cech klinicznych pozwalających na różnicowanie łuszczycy należą: początek i przebieg choroby oraz nasilenie, morfologia i dystrybucja zmian. Najczęściej obserwowanym fenotypem jest łuszczyca plackowata, która dotyczy ok. 90% wszystkich pacjentów [7]. Znacznie rzadziej występują: łuszczyca grudkowa, łuszczyca krostkowa, acrodermatitis continua Hallopeau, postać erytrodermiczna. Warto podkreślić, że zmiany chorobowe lokalizujące się na skalpie, w przestrzeni międzypośladkowej lub na płytkach paznokciowych, a także wieloletni wywiad łuszczycy plackowatej wpływają na zwiększone ryzyko zachorowania na ŁZS, przy czym szczególnie istotny związek dotyczy płytek paznokciowych, których uszkodzenie występuje u mniej więcej 40% pacjentów z łuszczycą oraz prawie 90% chorych na ŁZS [8].
Poza manifestacjami skórnymi i paznokciowymi w obraz kliniczny ŁZS wpisuje się zapalenie błony maziowej, przyczepów ścięgnistych, stawów kręgosłupa, palców, rzadziej błony naczyniowej oka i nieswoiste zapalenie jelit. W przypadku stawów można mówić o objawach osiowych i/lub obwodowych.
Stosowana w praktyce klinicznej klasyfikacja Moll i Wright wyróżnia pięć głównych postaci klinicznych ŁZS. Są to:
- asymetryczna postać nielicznostawowa (najczęstsza, dotyczy ok. połowy pacjentów),
- symetryczna postać wielostawowa,
- postać ŁZS z zajęciem paliczków dystalnych,
- postać okaleczająca,
- postać osiowa [9–11].
Zgodnie z rekomendacjami Polskiego Towarzystwa Dermatologicznego z 2020 r. obraz kliniczny łuszczycy w większości przypadków pozwala na ustalenie rozpoznania choroby. Natomiast w sytuacjach wątpliwych pomocna może być dermoskopia ognisk chorobowych oraz ocena histopatologiczna wycinka pobranego ze skóry zmienionej chorobowo [12].
W praktyce klinicznej do klasyfikacji ŁZS najczęściej stosuje się kryteria CASPAR z 2006 r., do których należą kryteria duże (zapalenie stawów) i kryteria małe (m.in. łuszczycowe zmiany skórne, zmiany paznokciowe, brak czynnika reumatoidalnego, charakterystyczne objawy radiologiczne). Brak specyficznych markerów choroby wiąże się z koniecznością ostatecznego rozpoznania ŁZS, opartego na potwierdzeniu objawów klinicznych i radiologicznych [10].
Nasilenie objawów choroby (łuszczycy, ŁZS)
Nasilenie procesu chorobowego w łuszczycy może być określone za pomocą wielu skal. Ich wyniki są podstawą do klasyfikacji łuszczycy na łagodną, umiarkowaną lub o ciężkim przebiegu, co przekłada się na dobór odpowiedniej terapii. Do najczęściej wykorzystywanych skal w praktyce klinicznej należą: PASI, BSA oraz DLQI.
PASI (Psoriasis Area and Severity Index) pozwala na zdefiniowanie nasilenia zmian skórnych, poprzez ocenę rumienia, nacieku i łuski, a także rozległości procesu chorobowego. Uznaje się, że wartość PASI poniżej 10 oznacza, że u pacjenta występuje łagodna postać choroby, natomiast powyżej 10 – umiarkowana lub ciężka. Istotna jest możliwość zastosowania skali PASI do monitorowania skuteczności terapeutycznej, z zastosowaniem PASI 50, PASI 75, PASI 90, PASI 100, gdzie odpowiednia wartość przy nazwie skali oznacza procentową poprawę stanu klinicznego pacjenta.
Pozostałe wskaźniki to BSA (Body Surface Area), służący do oceny powierzchni ciała zajętej przez zmiany chorobowe oraz DLQI (Dermatology Life Quality Index), który jest wykorzystywany do oceny jakości życia chorych na łuszczycę. W przypadku BSA i DLQI wynik powyżej 10 stanowi istotną wartość, pozwalającą na uznanie łuszczycy za odpowiednio od umiarkowanej do ciężkiej oraz mocno obniżającą jakość życia. [12]
Ocena aktywności ŁZS,...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.