Wstęp
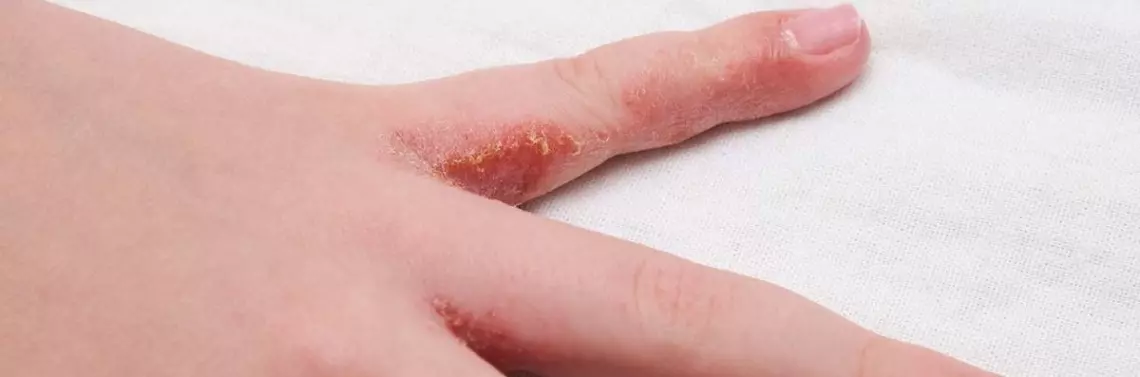
Atopowe zapalenie skóry (AZS, atopic dermatitis), inaczej zwane wypryskiem atopowym (atopic eczema), to częsta zapalna choroba skóry o przewlekłym przebiegu, charakteryzującym się okresami zaostrzeń i remisji. Choroba dotyka zarówno dzieci, jak i dorosłych, z przewagą tych pierwszych. Częstość występowania AZS w populacji pediatrycznej to ok. 20–30% w zależności od źródła, u dorosłych częstość AZS nie przekracza 10% [1, 2]. Do podstawowych objawów klinicznych choroby należą świąd i suchość skóry oraz wykwity skórne o morfologii wyprysku w typowej, zależnej od wieku lokalizacji. Choroba znacząco pogarsza jakość życia i wywiera negatywne wpływy społeczne oraz ekonomiczne [3]. AZS często współistnieje z innymi chorobami o zbliżonym podłożu patogenetycznym, takimi jak alergiczny nieżyt nosa, astma i alergia pokarmowa. W ostatnich latach zwraca się też uwagę na współwystępowanie AZS z chorobami psychicznymi, autoimmunologicznymi, sercowo-naczyniowymi czy neurologicznymi [4].
U podłoża rozwoju AZS leżą czynniki genetyczne oraz środowiskowe, uszkodzenie bariery naskórkowej, zaburzenia immunologiczne, zakłócenie równowagi mikrobiologicznej. Wszystkie one wzajemnie na siebie oddziałują.
Uszkodzenie bariery naskórkowej w AZS objawia się upośledzeniem obrony mechanicznej, immunologicznej i przeciwmikrobiologicznej [5]. Filagryna (FLG), białko strukturalne spajające włókna keratynowe, odgrywa kluczową rolę w funkcjonowaniu bariery naskórkowej [6, 7]. Przemiany FLG prowadzą do powstania związków wchodzących w skład tzw. naturalnego czynnika nawilżającego (NMF) oraz utrzymywania prawidłowego pH skóry, które jest niezbędne do prawidłowego przebiegu wielu procesów w naskórku. Mutacje FLG dotyczą niemal 40% pacjentów z AZS
[6, 7]. U tych chorych, u których mutacja nie występuje, prawidłowe wykształcenie FLG może być zakłócone nadmierną aktywnością niektórych cytokin zapalnych (IL-4, IL-13, IL-25, IL-31) i przewlekłym stanem zapalnym w skórze [5, 8, 9]. Poza zaburzeniem ekspresji białek koperty rogowej w AZS dotyczącym obok FLG także lorykryny, inwolukryny, repetyny, kornuliny i innych [10] uszkodzenie bariery naskórkowej wynika z zaburzonych proporcji w składzie lipidów (tj. cholesterolu, kwasów tłuszczowych oraz ceramidów) wypełniających przestrzenie między komórkami warstwy rogowej. Defekt bariery naskórkowej pogłębiany jest przez nadmierną aktywność proteaz serynowych. Ponadto nieprawidłowości dotyczą tzw. ścisłych połączeń (tight junctions) między komórkami warstw naskórka [11]. Uszkodzenie bariery naskórkowej wiąże się z nadmierną przeznaskórkową utratą wody (TEWL), ułatwiona jest penetracja i szkodliwe działanie alergenów, patogenów oraz haptenów kontaktowych [5].
Zaburzona odpowiedź immunologiczna w AZS dotyczy przede wszystkim limfocytów pomocniczych typu 2 (Th2), a także Th22, Th17, Th1, zwiększonej produkcji wydzielanych przez nie cytokin (IL-4, IL-13, IL-17,
IL-31, IL-22) oraz cytokin bezpośrednio wywodzących się z uszkodzonego naskórka (IL-25, IL-33, TSLP), nadprodukcji przeciwciał klasy IgE, nadmiernej aktywacji mastocytów oraz zaburzonej funkcji komórek Langerhansa [5, 8, 12–14].
Zakłócenie równowagi mikrobiologicznej polega na kolonizacji skóry przez Staphylococcus aureus i dominacji gronkowca złocistego, zwłaszcza w okresie zaostrzeń choroby [15]. Patogen pogłębia uszkodzenie bariery naskórkowej, prowadzi do nasilenia stanu zapalnego oraz świądu [16, 17]. Zasiedleniu skóry atopowej przez gronkowca złocistego sprzyja charakterystyczny dla tej choroby niedobór peptydów antybakteryjnych oraz zaburzona funkcja receptorów toll-like (toll-like receptors), które stanowią element naturalnej odporności wrodzonej [5].
Ze względu na złożoną patogenezę AZS leczenie tej choroby skupia się na kilku aspektach: profilaktyce choroby, rekonstrukcji bariery naskórkowej, działaniu przeciwzapalnym, przywróceniu równowagi mikrobiologicznej. Celem leczenia jest redukcja liczby zaostrzeń, wydłużanie czasu między kolejnymi zaostrzeniami, poprawa jakości życia pacjentów, zmniejszenie kosztów terapii, zapobieganie rozwojowi chorób współistniejących.
Niniejszy artykuł ma za zadanie przedstawić obecnie dostępne formy leczenia AZS oraz przybliżyć innowacyjne strategie lecznicze na podstawie najnowszych danych z piśmiennictwa i wytycznych leczenia AZS [18–22].
POLECAMY
Leczenie azs
Leczenie AZS to strategia. Wymaga planu i kontroli. Wybór terapii zależy od nasilenia choroby, wieku pacjenta oraz chorób współistniejących. Terapia powinna być prowadzona nie tylko w okresie zaostrzenia choroby, ale także w czasie remisji.
Skale wykorzystywane do oceny nasilenia AZS
Do oceny nasilenia choroby, a także pomocne w monitorowaniu leczenia są powszechnie dostępne i zwalidowane skale pozwalające określić ciężkość choroby, m.in. SCORAD (Scoring of Atopic Dermatitis), EASI (Eczema Area and Severity Index), Patient-Oriented Eczema Measure (POEM). Skale przygotowane w wersji dla pacjentów są dostępne w aplikacjach. Włączenie w terapię AZS elementu samokontroli pozwala zwiększyć skuteczność leczenia.
https://www.fondation-dermatite-atopique.org/pl/dla-pacjentow-rodzicow-rodziny/aktualnosci/po-scorad-nowa-wersja-0
Pierwszy krok w terapii AZS
Terapia AZS rozpoczyna się od edukacji, rzetelnej informacji, jak również dobrej współpracy lekarz–pacjent [23]. W sytuacjach ujawnienia klinicznie istotnych alergenów rekomendowane jest ich unikanie z zastosowaniem odpowiedniej profilaktyki [18, 20, 21].
Codzienna pielęgnacja skóry oparta na emolientach
Skóra pacjentów cierpiących na AZS charakteryzuje się zmniejszoną ilością lipidów tworzących warstwę rogową naskórka oraz ubogą zawartością naturalnego czynnika nawilżającego (NMF), tj. mieszaniny substancji o charakterze higroskopijnym, zapewniającej retencję wody w skórze [24]. Dlatego też w tej grupie chorych podstawą leczenia przewlekłego jest odpowiednia terapia emolientowa, zapewniająca uzupełnienie niezbędnych składników budujących barierę naskórkową i przywracających jej prawidłową funkcję [18, 20, 21]. Wśród substancji zawartych w emolientach możemy wyróżnić:
- cząsteczki uszczelniające barierę naskórkową, do których zaliczamy m.in. ceramidy, cholesterol, kwasy tłuszczowe omega-3 i omega-6 (3:1:1), prowadzące do zmniejszenia przeznaskórkowej TEWL,
- preparaty okluzyjne, m.in. wazelinę, parafinę, oleje mineralne, lanolinę,
- humektanty, do których należą m.in. mocznik, sorbitol, glicerol oraz kwas mlekowy, wpływające na stan uwodnienia warstwy rogowej naskórka [18, 25].
Dzięki wielu badaniom udowodniono skuteczność emolientów w profilaktyce wtórnej, czyli redukcji zaostrzeń choroby zarówno u dorosłych, jak i u dzieci [20, 21]. Regularne stosowanie powyższych preparatów pozwala zmniejszyć ilość stosowanych glikokortykosteroidów miejscowych, które nadal pozostają podstawowym lekiem w okresie zaostrzeń choroby [18, 20, 21, 26].
Nowoczesne emolienty, tzw. emolienty plus, są wzbogacone o składniki pochodzenia naturalnego, takie jak flawonoidy czy saponiny lub ekstrakty/ lizaty bakteryjne. Dzięki nim poza swoim standardowym działaniem przywracają one równowagę mikorobiologiczną, wywierają pewne działanie przeciwzapalne, przeciwświądowe oraz wspomagają odporność wrodzoną. Mimo że pochodzą z wyciągów roślinnych, nie zawierają białek, które mogłyby doprowadzić do przeznaskórkowego uczulenia i rozwoju alergii [18, 21].
Zalecane jest stosowanie emolientów w ilości ok. 30 g dziennie lub 1 kg na miesiąc. U dzieci to ilość do 200 g na tydzień, u dorosłego – do 500 g na tydzień (średnio ok. 250 g na tydzień u dorosłego) [18, 20, 21]. Konieczna jest aplikacja emolientów minimum dwa razy dziennie [18, 20, 21]. W celu utrzymania odpowiedniego nawodnienia polecane są emolienty zawierające glicerol lub 5-proc. mocznik [20].
Emolienty cechują się bardzo szerokim profilem bezpieczeństwa. Nie zaleca się stosowania preparatów zawierających białka roślinne, które mogą prowadzić do rozwoju uczulenia drogą przeznaskórkową, takich jak arachidy, owies oraz pszenica, zwłaszcza u pacjentów poniżej drugiego roku życia [18, 20]. Należy unikać emolientów zawierających substancje zapachowe, barwniki, konserwanty lub inne substancje, które mogą prowadzić do uczulenia kontaktowego [18, 20, 21].
Należy podkreślić, że zbyt częste, nieprawidłowe oczyszczanie skóry może paradoksalnie prowadzić do pogłębienia przeznaskórkowej utraty wody u pacjentów z AZS. Skóra powinna być oczyszczana dokładnie, ale bardzo delikatnie [20]. Podczas mycia należy ostrożnie usuwać strupy oraz martwy naskórek. Środki stosowane do mycia skóry atopowej są dostępne w różnych formach galenicznych. Powinny zapewniać utrzymanie pH skóry na poziomie 5–6, nie podrażniać skóry ani nie powodować uczulenia [18, 20]. Mogą być wzbogacone substancjami antyseptycznymi zależnie od stanu klinicznego [20]. Kąpiele pacjentów z AZS powinny być krótkie, ich czas nie powinien przekraczać 5 min [18, 20]. Zalecana częstość stosowania kąpieli to od dwóch do siedmiu razy na tydzień z zachowaniem prawidłowego nawilżenia skóry po kąpieli poprzez zaaplikowanie preparatu emolientowego bezpośrednio po zakończeniu kąpieli czy prysznica, gdy skóra jest jeszcze wilgotna [20]. Temperatura wody podczas kąpieli powinna wynosić 27–30°C [18, 20, 21].
Ze środków antyseptycznych preparatem odpowiednim w przypadku infekcji S. aureus jest podchloryn sodu w stężeniu 0,005–0,006% [18, 20, 27]. Jego skuteczność została wykazana szczególnie w przypadku oporności na miejscowe leczenie oraz znaczne nasilenie świądu [27].
Miejscowe leczenie przeciwzapalne
Zmiany zapalne pojawiają się w niemal każdej postaci AZS, dlatego też miejscowe leczenie przeciwzapalne stanowi nieodzowny element postępowania terapeutycznego. W powyższej grupie leków mamy do dyspozycji miejscowe preparaty glikokortykosteroidowe (mGKS), miejscowe inhibitory kalcyneuryny (mIK) oraz inhibitory fosfodiesterazy 4 (miPDE 4). Aby osiągnąć adekwatny efekt leczenia, należy zwrócić uwagę nie tylko na prawidłowo dostosowaną siłę oraz dawkę preparatu, ale również na jego odpowiednią aplikację [28].
Miejscowe glikokortykosteroidy (mGKS)
Glikokortykosteroidy stanowią ważną i rekomendowaną grupę miejscowych leków przeciwzapalnych w leczeniu zaostrzeń AZS [18, 20, 21]. Wybór konkretnego miejscowego preparatu steroidowego powinien być uzależniony od wieku pacjenta, lokalizacji wyprysku, zajętej powierzchni ciała, zaawansowania stanu zapalnego, siły działania substancji czynnej, postaci galenicznej oraz rejestracji danego mGKS. Siła działania GKS określana jest za pomocą czterostopniowej klasyfikacji europejskiej, przy czym I stopień oznacza GKS o słabej sile działania, a IV stopień – najsilniejsze preparaty steroidowe [28]. W leczeniu AZS preferowane są mGKS II i III klasy według Niednera [1, 20, 21]. Twarz oraz okolice wyprzeniowe stanowią obszary o wysokim ryzyku atrofii spowodowanej przez mGKS, dlatego też należy unikać ich stosowania w obrębie ww. okolic. Na wspomniane obszary sugeruje się aplikowanie miejscowych inhibitorów kalcyneuryny (patrz niżej) [18].
Nieodpowiednie stosowanie mGKS może prowadzić do licznych działań niepożądanych, takich jak atrofia skóry, teleangiektazje, rozstępy, trądzik, przebarwienia [18]. W piśmiennictwie opisywano również przypadki supresji kory nadnerczy będącej skutkiem miejscowej terapii GKS, zwłaszcza sterydów należących do III i IV grupy [29]. U niemowląt w przypadku niewłaściwego użycia sterydów może rozwinąć się ziarniniak pieluszkowy [30]. Ryzyko działań niepożądanych jest zredukowane w przypadku względnie nowych preparatów o krótkim okresie półtrwania, m.in. flutikazonu oraz mometazonu [31].
Ilość stosowanych mGKS pomaga określić przyjęta nomenklatura tzw. FTU (finger tip unit), w przybliżeniu ilość substancji wyciśniętej z tubki o średnicy ujścia
5 mm, mieszcząca się na opuszce palca. Ilość ta pokrywa powierzchnię dłoniową rąk i w przybliżeniu odpowiada 2% powierzchni skóry ciała osoby dorosłej. Przyjmuje się, że u niemowląt to ok. 15 g/mc, u dzieci – do 30 g/mc,
natomiast u dorosłych – 60–90 g/mc [20]. Zgodnie z rejestracją po pierwszym roku życia można stosować propionian flutikazonu, alklometazon oraz walerianian betametazonu, natomiast furoinian mometazonu, aceponian metylprednizolonu są zarejestrowane powyżej drugiego roku życia [18].
Ustąpienie świądu uważa się za jeden z najważniejszych efektów działania mGKS i wykładników skuteczności terapii miejscowej. W celu redukcji świądu efektywna może być aplikacja mGKS raz w ciągu dnia, w godzinach wieczornych [18, 28].
Odpowiednie odstawianie mGKS jest niezwykle istotne ze względu na ryzyko efektu z odbicia przy zbyt gwałtownej redukcji dawki [20]. W celu odstawienia leku początkowo należy przeprowadzić konwersję mGKS do leku o mniejszej sile działania, utrzymać leczenie poprzednio stosowanym preparatem przy mniejszej częstości aplikacji w ciągu dnia lub przejść na leczenie miejscowymi inhibitorami kalcyneuryny [20].
Warto zaznaczyć, że jedną z najistotniejszych przyczyn zaostrzeń AZS jest niestosowanie się pacjentów do zaleceń lekarskich. Tak zwana fobia steroidowa, która nie ma swojego uzasadnienia w sytuacji rozsądnie prowadzonego leczenia przeciwzapalnego, jest jednym z elementów utrudniających osiągnięcie skutecznego efektu terapeutycznego przeciwzapalnego [32].
Miejscowe inhibitory kalcyneuryny (mIK)
Miejscowe inhibitory kalcyneuryny stanowią ważne leczenie przeciwzapalne i zajmują istotne miejsce w terapii AZS. Ich skuteczność w leczeniu AZS potwierdzono licznymi badaniami klinicznymi [33–38]. mIK obejmują dwa leki zarejestrowane do leczenia AZS: takrolimus w maści (0,03% oraz 0,1%) i pimekrolimus w kremie (1%). Leki te poza działaniem przeciwzapalnym mają zdolność rekonstrukcji bariery naskórkowej. Preferowane są do stosowania na skórze w obrębie powiek, wokół ust, w okolicy genitalnej, pachowej.
W przeciwieństwie do mGKS miejscowe inhibitory kalcyneuryny nie powodują długoterminowych uszkodzeń skóry, a wręcz mają do pewnego stopnia zdolność odwracania miejscowych szkód posterydowych. Nie powodują zahamowania funkcji nadnerczy, jaskry ani zaćmy [20]. Najczęstsze działania niepożądane mIK obejmują uczucie ciepła, mrowienia oraz palenia w miejscu aplikacji podczas pierwszych dni stosowania leku i są to objawy przejściowe [39]. Leki te są zarejestrowane w leczeniu AZS od drugiego roku życia, do zastosowania dwa razy dziennie – takrolimus dla umiarkowanego i ciężkiego AZS, pimekrolimus dla łagodnego i umiarkowanego AZS. Bezpieczeństwo stosowania tych leków potwierdzono licznymi badaniami, w tym 10-letnim badaniem obserwacyjnym [39–41]. W przypadku stosowania mIK zalecana jest efektywna ochrona przeciwsłoneczna.
Terapia proaktywna
Terapia proaktywna to długoterminowa terapia podtrzymująca, polegająca na miejscowej aplikacji niskich dawek preparatów przeciwzapalnych stosowanych w miejscach uprzednio objętych przez proces chorobowy z jednoczesnym stosowaniem emolientów [42]. Ta forma leczenia ma za zadanie redukować i kontrolować subkliniczny stan zapalny w skórze w okresach pozornej remisji choroby. Skuteczność i bezpieczeństwo terapii proaktywnej stosowanej dwa razy w tygodniu z użyciem takrolimusu potwierdzono licznymi badaniami [19, 20, 43, 44]. Prowadzi ona do statystycznie istotnej redukcji liczby zaostrzeń AZS, wydłużenia czasu do kolejnego zaostrzenia choroby, poprawy jakości życia pacjentów oraz niższego kosztu terapii zarówno w grupie dzieci, jak i dorosłych z AZS [43, 44].
Inhibitory fosfodiesterazy
Krisaborol, niesteroidowy lek przeciwzapalny, stanowi innowacyjną propozycję leczniczą w AZS. Mechanizm działania preparatu jest odmienny od mechanizmu działania mGKS i mIK. Krisaborol działa poprzez blokowanie fosfodiesterazy 4, enzymu odgrywającego znaczącą rolę w rozwoju zapalenia oraz pośrednio wydzielania takich cytokin jak TNF-alfa, IL-12, IL-23. Lek w mechanizmie pośrednim poprawia również funkcję bariery naskórkowej.
Krisaborol został zarejestrowany w Stanach Zjednoczonych do leczenia miejscowego łagodnej i umiarkowanej postaci AZS od drugiego roku życia [45]. Lek w stężeniu 2% redukuje objawy kliniczne obiektywne oraz subiektywne (świąd) AZS [46].
Jeżeli leczenie miejscowe nie działa?
Warto w tym miejscu zwrócić uwagę, że w przypadku braku odpowiedzi na adekwatnie prowadzone leczenie miejscowe należy wykluczyć narażenie pacjenta na kontakt z substancjami drażniącymi. Wśród czynników zaostrzających należy uwzględnić czynniki infekcyjne, przebywanie w środowiskach o wysokiej temperaturze oraz obniżonej wilgotności powietrza, stres, częste kąpiele bez nawilżenia skóry, narażenie na kontakt z rozpuszczalnikami i detergentami. W związku z uszkodzoną barierą ochronną skóry chorzy z AZS są bardziej podatni na bakteryjną kolonizację skóry oraz wnikanie immunizujących haptenów będących przyczyną alergii kontaktowej. W razie wystąpienia zmian skórnych o nietypowej lokalizacji oraz rozprzestrzeniania się wykwitów mimo prowadzenia intensywnej terapii miejscowej należy podejrzewać obecność alergii kontaktowej [47].
Kolejnym przyczynkiem do braku skuteczności leczenia miejscowego może być nieprzestrzeganie zaleceń lekarskich, błędne ich interpretowanie, nieznajomość zasad emolientoterapii. Warto zwrócić uwagę na te aspekty, zapisywać pacjentom zalecenia, odbywać regularne wizyty, przypominać o podstawowych zasadach pielęgnacji skóry, wesprzeć pacjentów rzetelną edukacją, skierować do szkół atopii, rozeznać potrzebę wsparcia psychologicznego.
Leczenie świądu w AZS
Świąd ma istotny negatywny wpływ na jakość życia chorych z AZS [48]. Patogeneza tego objawu jest złożona. Zaangażowany jest tu obwodowy i centralny układ nerwowy oraz układ neuroendokrynny. Dużą komponentę stanowi tzw. świąd histaminoniezależny.
W leczeniu świądu kluczowe jest odpowiednie nawodnienie oraz nawilżenie skóry, jak również miejscowe leczenie przeciwzapalne [49, 50]. Rekomendowane jest w tym celu stosowanie odpowiednich emolientów oraz leków przeciwzapalnych, np. mGKS, które wykazują działanie przeciwświądowe [18, 20, 21]. Leki przeciwhistaminowe nie są rekomendowane do powszechnego stosowania w opanowywaniu świądu w AZS [18, 20, 21]. Dopiero w przypadku braku możliwości kontrolowania świądu za pomocą leczenia miejscowego zaleca się włączenie leków przeciwhistaminowych drugiej i/lub pierwszej generacji, o ile nie istnieją inne wskazania do wcześniejszego zastosowania leków przeciwhistaminowych drugiej generacji, np. współistniejący alergiczny nieżyt nosa czy pokrzywka [51].
W leczeniu świądu w AZS można zastosować polidokanol [20, 21]. Jest to miejscowy lek znieczulający o udowodnionym działaniu przeciwświądowym. Preparat zapewnia bardzo szybką redukcję najbardziej dokuczliwego objawu AZS [52]. Do opanowania tego uporczywego objawu próbuje się stosować również inne leki z grupy środków anestetycznych, m.in. benzokainę czy lidokainę [53]. W piśmiennictwie pojawiają się również wzmianki wskazujące na efektywne przeciwświądowe działanie kapsaicyny [54]. Jej działanie jest oparte na blokowaniu kanału jonowego TRPV1 biorącego udział w percepcji bodźców zewnętrznych. Jednak wiedza dotycząca zastosowania powyższego alkaloidu opiera się jedynie na opisie przypadków klinicznych oraz pojedynczych badaniach eksperymentalnych [55, 56].
Alternatywną metodę leczenia świądu w AZS, która jest stosowana stosunkowo powszechnie, stanowi fototerapia. Największą skuteczność w redukcji świądu obserwowano w przypadku wąsko spektralnego promieniowania B (NVUVB) oraz promieniowania ultrafioletowego A1 [20, 21] (patrz akapit fototerapia).
Leczenie przeciwinfekcyjne
Zaburzenie flory bakteryjnej skóry pacjentów z AZS, zubożenie jej bioróżnorodności, upośledzenie miejscowej odporności wrodzonej zwiększają predyspozycję chorych z AZS do infekcji skóry i odgrywają znaczącą rolę w obrazie klinicznym choroby.
Zakażenie bakteryjne
Skóra pacjentów cierpiących z powodu AZS w 90% może być skolonizowana przez bakterie rodzaju Staphylococcus aureus. Kolonizacji bakteryjnej sprzyja drapanie, brak elementów naturalnej wrodzonej odporności, jak peptydy antybakteryjne. Sam gronkowiec złocisty poprzez różne mechanizmy prowadzi do nasilenia stanu zapalnego w skórze oraz świądu i uszkodzenia bariery naskórkowej [16, 17, 57]. Gronkowiec złocisty dominuje nad florą bakteryjną skóry zwłaszcza w okresie zaostrzeń AZS [15]. Dodatkowo obecność gronkowca może się przyczynić do wyindukowania oporności na sterydoterapię [58].
Leczenie antybiotykami w AZS zalecane jest tylko w obliczu stwierdzenia klinicznych cech występowania objawów infekcji S. aureus/ nadkażenia bakteryjnego [18, 20, 21]. W takim przypadku można rozważyć krótkoterminowe zastosowanie cefalosporyny [20, 21]. W leczeniu miejscowym przeciwbakteryjnym do dyspozycji pozostają: kwas fusydowy, mupirocyna i retapamulina [18, 20, 21, 59]. Długoterminowa antybiotykoterapia nie jest jednak zalecana ze względu na ryzyko pojawienia się oporności, ryzyko wyindukowania szczepów opornych oraz uczulenia kontaktowego [18, 20, 21, 60].
Warto nadmienić, że źródło bakterii może stanowić opakowanie na krem lub maść. Z tego względu podkreśla się zasadność przechowywania środków nawilżających przechowywanych w otwartych pojemnikach w lodówce, używania opakowań z pompką, unikania współdzielenia środków higieny osobistej [20, 61]. Stosowanie mGKS oraz mIK zmniejsza ryzyko kolonizacji gronkowcem złocistym [20].
Zakażenie wirusowe
U pacjentów z AZS częściej niż w populacji ogólnej obserwuje się występowanie infekcji wirusowych. Co więcej, są oni bardziej narażeni na rozsianą postać zakażenia [20]. Przykładem zakażenia wirusem często wikłającego przebieg AZS jest infekcja Herpex simplex [62]. Do infekcji predysponują:
- wczesny początek AZS,
- ciężkie, nieadekwatnie leczone postacie choroby,
- niedobór filagryny,
- wysokie stężenie IgE w osoczu.
Zakażenie początkowo manifestujące się rozsianymi pęcherzykami, gorączką oraz powiększeniem węzłów chłonnych może stanowić przyczynę groźnych powikłań, takich jak zapalenie rogówki i spojówek, zapalenie opon mózgowych i mózgu. Natychmiast po wykryciu zakażenia zaleca się niezwłoczne wdrożenie leczenia acyklowirem lub walacyklowirem [18, 20, 21].
Infekcje grzybicze
Ze względu na dysfunkcyjną barierę naskórkową u pacjentów z AZS grzyby rodzaju Malassezia spp. kolonizujące skórę osób zdrowych mogą mieć znaczenie chorobotwórcze i prowadzić do powstania odmiany AZS tzw. head and neck atopic dermatitis, charakteryzującej się nasileniem zmian o charakterze wyprysku atopowego i rumienia zapalnego w obrębie skóry twarzy i szyi [20, 63, 64]. W takich sytuacjach skuteczne jest wdrożenie leczenia przeciwgrzybiczego miejscowego lub ogólnego [18, 20, 21, 65].
Fototerapia
Fototerapia stanowi uznaną metodę poprawiającą stan miejscowy zmian skórnych, redukującą świąd oraz zaburzenia snu u pacjentów z AZS. Mechanizm działania powyższej formy leczenia jest oparty m.in. na hamowaniu aktywności komórek prezentujących antygen, a co za tym idzie – wydzielania prozapalnych cytokin [66, 67]. Ponadto fototerapia przyczynia się do zwiększenia grubości warstwy rogowej naskórka. Powyższa metoda jest stosowana u dorosłych i dzieci z ciężką lub umiarkowaną postacią AZS, która nie jest kontrolowana za pomocą leczenia miejscowego [18, 20, 21]. Najczęściej wykorzystuje się wąsko spektralne promieniowanie UVB 311 nm oraz promieniowanie UVA1. UVA z psoralenami (PUVA) stosowane jest rzadko, a jeśli, to w grupie dorosłych [20, 21].
Przeciwwskazaniem do fototerapii są: klaustrofobia, padaczka, choroby nowotworowe, choroby przebiegające z nadwrażliwością na światło, przyjmowanie niektórych leków, a w przypadku PUVA również przeciwwskazania do stosowania psoralenów. Pewnym ograniczeniem tej formy terapii mogą być częste wizyty w ośrodku prowadzącym leczenie oraz problemy logistyczne [68].
Metoda mokrych opatrunków
Metoda mokrych opatrunków (WWT) jest krótkoterminową, skuteczną, relatywnie bezpieczną opcją terapeutyczną u pacjentów, głównie dzieci od szóstego miesiąca do 10. roku życia z ciężką, oporną na leczenie postacią AZS (SCORAD >50 pkt) [69–71]. Należy ją rozważyć szczególnie u pacjentów, u których standardowa terapia miejscowa nie przynosi spodziewanych efektów – u chorych, u których stwierdza się występowanie ostrych, sączących zmian skórnych oraz nadżerek, z ciężkim AZS [69–71]. Metoda ta zapewnia m.in. lepsze wchłanianie oraz znaczne wydłużenie działania leków, ograniczenie dawki stosowanego preparatu, redukcję świądu oraz wazokonstrykcję, co przekłada się na zmniejszenie zmian rumieniowych. Redukuje świąd i zaburzenia snu, wywiera efekt przeciwzapalny, jak również chłodzący. Dodatkowo zapewnia ochronę przed drapaniem [69, 70, 72, 73]. Terapia zazwyczaj trwa ok. trzech dni, nie powinna przekraczać dwóch tygodni [69–74]. Polega na zastosowaniu mGKS w odpowiednim rozcieńczeniu i dwóch warstw opatrunków, z których pierwsza jest wilgotna. Prowadzona jest najczęściej z użyciem propionianu flutikazonu lub furoinianu mometazonu w rozcieńczeniu 1:10 lub 1:20 w zależności od wieku pacjenta i okolicy ciała oraz doświadczenia ośrodka prowadzącego leczenie [69–75]. Zważywszy na wywierany efekt okluzyjny i stosowane leki, powinna być prowadzona pod ścisłą kontrolą doświadczonego w tej metodzie lekarza, z monitorowaniem odpowiednich parametrów [69–71].
Mokre opatrunki mogą być też stosowane z zastosowaniem emolientu [18]. Ich aplikowanie w tej formie może być powszechne, jednak efekt terapeutyczny jest słabszy [71, 76].
Leczenie ogólne
Leczenie ogólne AZS stosowane jest u pacjentów z ciężkim przebiegiem choroby (SCORAD >50 pkt), u których leczenie miejscowe nie zapewnia dostatecznej kontroli objawów. Do stosowanych leków immunosupresyjnych można zaliczyć cyklosporynę A, glikokortykosteroidy systemowe, metotreksat, azatioprynę oraz mykofenolan mofetylu. Te trzy ostatnie, choć skuteczne w leczeniu AZS, stanowią grupę leków off-label w tym wskazaniu. Od 2017 r. portfolio terapeutyczne AZS zostało poszerzone o pierwszy lek biologiczny – dupilumab, a w 2020 r. o pierwszy inhibitor kinaz
janusowych – baricitinib.
Cyklosporyna (CyA)
Spośród leków immunosupresyjnych za lek pierwszego rzutu w leczeniu ciężkiej postaci AZS uważana jest cyklosporyna A (CsA). Mechanizm działania preparatu opiera się na hamowaniu reakcji immunologicznych, modyfikowaniu przebiegu zapalenia oraz zmniejszeniu wytwarzania i wydzielania cytokin, w tym interleukiny 2 oraz czynnika wzrostu komórek [77]. Jest wskazana w leczeniu AZS o umiarkowanym oraz ciężkim przebiegu [19, 20, 22]. Początkowo zaleca się stosowanie CsA w dawce 5 mg/kg/d w dwóch dawkach podzielonych. Po osiągnięciu skuteczności klinicznej zaleca się redukcję dawki
o 0,5–1 mg/kg/d co mniej więcej dwa tygodnie [19, 20, 22].
Zmniejszenie dawki należy rozważać zależnie od skuteczności klinicznej. W wybranych przypadkach może być wskazane długotrwałe leczenie najniższą klinicznie skuteczną dawką preparatu. Leczenie preparatem nie powinno przekroczyć okresu dwóch lat. Czas leczenia CsA jest dyktowany kliniczną skutecznością i tolerancją leku [19, 20, 22].
Do działań niepożądanych ograniczających zastosowanie leku należą m.in. nefrotoksyczność, nadciśnienie tętnicze, przerost dziąseł oraz zwiększona podatność na infekcje. W trakcie terapii przewlekłej wskazane jest monitorowane funkcji nerek oraz pomiar ciśnienia tętniczego [19, 20, 22]. Ze względu na częste występowanie działań niepożądanych zaleca się terapie przerywane – terapię co trzy–sześć miesięcy lub tzw. terapię weekendową [19, 20, 22, 78].
Leczenie CsA można rozważyć również u dzieci i młodzieży w przypadku opornego lub ciężkiego przebiegu choroby, jednak szczególnie w tej grupie pacjentów niezwykle istotne jest monitorowanie działania leku pod kątem działań niepożądanych, zwłaszcza ze strony nerek [19, 20, 22].
GKS systemowe
W wielu krajach w leczeniu AZS stosowane są doustne GKS. Ich zastosowanie ograniczają liczne efekty uboczne związane z długotrwałym leczeniem. Według wytycznych można rozważyć krótkoterminowe podawanie GKS w przypadku ostrego rzutu choroby u pacjentów z ciężkim przebiegiem AZS [19, 20, 22]. Dawka nie powinna przekraczać 0,5 mg/kg.
Decyzję o włączeniu GKS systemowych u dzieci należy podejmować z jeszcze większą rozwagą. Leczenie powinno być ograniczone i możliwie krótkie, zwłaszcza w grupie pediatrycznej [20].
Metotreksat
Metotreksat (MTX) jest proponowany w leczeniu ciężkiego, opornego na dotychczasowe leczenie AZS u dorosłych i u dzieci [19, 20, 22]. Zalecane dawki są zbliżone do tych w leczeniu łuszczycy lub niższe. U dorosłych terapię rozpoczyna się od 5–15 mg/tydz., przy czym dawka podtrzymująca wynosi 15–25 mg/tydz. [19, 20, 22]. U dzieci początkowo stosuje się 10–15 mg/m2/tydz., a następnie kontynuuje się terapię, podając 2,5–5 mg/tydz.
jako leczenie podtrzymujące [20, 22]. Zastosowanie w obu grupach wiekowych jest off-label.
MTX jest teratogenny – podczas leczenia obowiązkowa jest skuteczna antykoncepcja zarówno u mężczyzn, jak i u kobiet [20, 79].
Azatiopryna (AZA)
Kolejnym lekiem ogólnym, rozwiązaniem przedstawianym dla terapii ciężkiego, opornego na leczenie miejscowe AZS, jest azatiopryna. Używana poza rejestracją w grupie dorosłych i dzieci, gdy leczenie CsA jest nieefektywne lub przeciwwskazane [20]. Cechuje się opóźnionym początkiem działania, efekt kliniczny obserwowany jest po 8–12 tygodniach terapii. U dorosłych zaleca się leczenie początkowe w dawce 50 mg/d i powolne zwiększanie dawki przy ścisłej kontroli parametrów morfologicznych i wątrobowych [20, 22].
Do najczęstszych efektów ubocznych leku należą działania niepożądane ze strony przewodu pokarmowego, wzrost enzymów wątrobowych oraz zaburzenia hematologiczne [80]. Przed rozpoczęciem terapii sugeruje się oznaczenie poziomu metylotransferazy tiopuryny (TPMT), ponieważ jej niska aktywność koreluje z większym ryzykiem mielotoksyczności preparatu [20, 22, 81]. Podczas stosowania AZA bardzo istotna jest skuteczna ochrona przeciw promieniom UV.
Mykofenolan mofetylu
Mykofenolan mofetylu (MMF) może być stosowany poza rejestracją w leczeniu ciężkiego AZS, jeżeli CsA jest nieskuteczna lub przeciwwskazana [20, 22, 82]. Dawka początkowa u dorosłych to 1–2 g/dz., natomiast w terapii podtrzymującej należy stosować 2–3 g/dz. U dzieci i młodzieży dawka początkowa to 20–50 mg/kg/d, na dalszym etapie leczenia zwiększa się ilość substancji leczniczej co dwa–cztery tygodnie do dawki 30–50 mg/kg/d [20, 22].
Należy podkreślić, że MMF jest lekiem teratogennym. Zarówno kobiety, jak i mężczyźni w wieku prokreacyjnym są zobowiązani stosować skuteczną antykoncepcję podczas terapii [20].
Leki biologiczne w AZS
Zaburzona odpowiedź układu immunologicznego odgrywa znaczącą rolę w patogenezie AZS i w tym obszarze znajdują się nowe cele terapeutyczne, którym poświęcone są najnowsze badania. Podkreśla się przeważającą rolę limfocytów Th2 oraz nadmierną aktywność bezpośrednio powiązanych z nimi cytokin, tj. IL-4, IL-13, IL-31. W patogenezę AZS zaangażowane są też limfocyty Th17, Th22 i wydzielane przez nie cytokiny oraz cytokiny pochodzące bezpośrednio z uszkodzonego naskórka, tj. IL-33, TSLP oraz IL-25 [12–14, 83]. Poza istotną rolą w rozwoju stanu zapalnego niektóre cytokiny mogą hamować ekspresję filagryny w naskórku i przez to pośrednio wpływać na zaburzenie struktury bariery naskórkowej [8, 9].
Z powyższych względów wiele projektów badawczych ukierunkowanych jest na poszukiwanie nowych możliwości tj. wprowadzanie do leczenia przeciwciał monoklonalnych hamujących poszczególne cytokiny oraz agonistów lub antagonistów małych cząsteczek odgrywających znaczącą rolę w przekazywaniu sygnału w komórce.
Pierwszym lekiem biologicznym zarejestrowanym do leczenia AZS jest dupilumab, ludzkie przeciwciało monoklonalne IgG4 skierowane przeciwko podjednostce alfa receptora dla IL-4 (IL-4Rα). Działanie preparatu polega na hamowaniu IL-4 i IL-13, cytokin produkowanych przez limfocyty Th2.
W 2017 r. lek został zarejestrowany w USA i Europie do leczenia dorosłych z ciężką i umiarkowaną postacią AZS. Lek podawany jest w zastrzyku, podskórnie, w dawce inicjującej 600 mg s.c., potem co dwa tygodnie 300 mg s.c. W marcu 2019 r. lek został zarejestrowany przez FDA w USA dla pacjentów w wieku 12–17 lat z umiarkowanym i ciężkim AZS, których choroba nie była wystarczająco kontrolowana leczeniem miejscowym lub jeśli te terapie są przeciwwskazane. W sierpniu 2019 r. EMA zatwierdziła dupilumab w Europie dla pacjentów dorosłych i młodzieży od 12. roku życia z umiarkowanym i ciężkim AZS, którzy są kandydatami do terapii ogólnej. W maju 2020 r. FDA dopuściła w USA dupilumab w leczeniu dzieci w wieku
6–11 lat z umiarkowanym i ciężkim AZS, których choroba nie jest dobrze kontrolowana przez leki miejscowe, a od listopada 2020 r. lek w tej grupie wiekowej u dzieci z ciężkim AZS został dopuszczony także w Europie. Lek podawany jest podskórnie w zastrzyku. Dawki zależne są od wieku i masy ciała.
Skuteczność działania dupilumabu weryfikowano drogą randomizowanych badań prowadzonych metodą podwójnie ślepej próby [84–87]. Dubilumab skutecznie redukował subiektywne i obiektywne objawy AZS oraz poprawiał jakość życia chorych pacjentów z ciężką oraz umiarkowaną postacią AZS, u których wcześniej stwierdzono niewystarczającą odpowiedź na leki stosowane miejscowo [85–87]. Najczęstsze działania niepożądane obejmowały zapalenie spojówek [85–87].
Skuteczność i bezpieczeństwo stosowania preparatu oceniono również u młodzieży powyżej 12. roku życia [88, 89]. Dupilumab znacząco poprawił objawy przedmiotowe i podmiotowe oraz jakość życia młodzieży z umiarkowaną oraz ciężką postacią AZS, przy akceptowalnym profilu bezpieczeństwa [88, 89]. Już po pierwszym podaniu obserwowano szybką i trwałą poprawę w zakresie nasilenia świądu [90]. Lek redukował uczucie lęku, objawy depresji oraz zaburzenia snu [90].
Dostępne są dane oceniające skuteczność i bezpieczeństwo leczenia dupilumabem u dzieci w wieku 6–11 lat [91]. W bieżącym roku ukazały się pismem pierwsze doniesienia o skuteczności i bezpieczeństwie zastosowania dupilumabu u najmłodszych pacjentów z ciężkim AZS w grupie od szóstego miesiąca życia do sześciu lat [92].
Obecnie kontynuowanie są badania nad innymi lekami biologicznymi. Weryfikacji poddawana jest skuteczność oraz profil bezpieczeństwa danych preparatów.
Lebrikizumab oraz tralokinumab to przeciwciała monoklonalne blokujące szlak IL-13. Wyniki badań prowadzonych nad tymi preparatami są obiecujące u pacjentów z ciężkim oraz umiarkowanym przebiegiem AZS. Lebrikizumab prowadził do znaczącej poprawy klinicznej i był dobrze tolerowany [93]. Leczenie tralokinumabem było związane z wczesną i trwałą poprawą objawów AZS przy akceptowalnym profilu bezpieczeństwa i tolerancji leku [94]. Badania są obecnie w fazie III.
Nemolizumab stanowi przeciwciało monoklonalne blokujące szlak sygnału IL-31. Cytokina odpowiada za rozwój reakcji zapalnej, działając na komórki efektorowe, jak również na obwodowe zakończenia nerwowe. Z tego względu odgrywa znaczącą rolę w patogenezie świądu. Nemolizumab powodował szybką i trwałą poprawę skórnych objawów zapalnych i świądu [95]. Stosowany przez okres do 64 tygodni okazał się skuteczny i był dobrze tolerowany [96]. Profil bezpieczeństwa nemolizumabu oceniono na akceptowalny [95, 96].
Interleukina 33 jest cytokiną, której aktywność może prowadzić do wzmożonej produkcji interleukin zależnych od limfocytów pomocniczych typu 2. Wydzielana jest w odpowiedzi na uszkodzenie komórek, dlatego w AZS stwierdza się jej podwyższone stężenie.
Etokimab, monoklonalne przeciwciało mające na celu hamowanie funkcji IL-33, jest w fazie badań IIa. Po podaniu jednorazowej dawki obserwowano poprawę objawów klinicznych [97].
Interleukina 22 sprzyja hiperplazji naskórka, hamuje różnicowanie keratynocytów oraz tworzenie bariery naskórkowej. Trwają badania nad fezakinumabem, preparatem, którego funkcja polegałaby na hamowaniu działania IL-22. Lek okazał się dobrze tolerowany, dawał długotrwałą poprawę kliniczną po ostatnim podaniu u pacjentów z AZS o ciężkim oraz umiarkowanym przebiegu [98].
Inny potencjalny cel terapeutyczny leczenia biologicznego stanowi limfopoetyna zrębu grasiczego (TSLP). To cytokina wydzielana do krążenia systemowego pod wpływem uszkodzonej bariery naskórkowej. Według piśmiennictwa odgrywa ona również znaczącą rolę w marszu alergicznym. Obecnie trwają badania w fazie IIa nad tezepelumabem, przeciwciałem monoklonalnym, które ma na celu zablokowanie TSLP [99].
Obok przeciwciał monoklonalnych w AZS badani są agoniści i antagoniści kinaz janusowych. Hamując szlaki sygnałowe JAK-STAT, cząsteczek transmitujących sygnał do jądra komórkowego, leki zatrzymują transkrypcję wielu genów, m.in. cytokin biorących udział w rozwoju stanu zapalnego. Zakres ich działania immunologicznego jest zatem szerszy i nie tak precyzyjny jak przeciwciał monoklonalnych. Leki powyższej grupy w przeciwieństwie do przeciwciał monoklonalnych mogą być podawane doustnie lub miejscowo. Badania prowadzone są wśród dorosłych i dzieci z łagodnym, umiarkowanym i ciężkim AZS. Wśród inhibitorów cząsteczek należy wymienić: abrocitinib oraz upadacitinib – selektywne inhibitory kinazy JAK1, baricitinib i ruxolitinib – selektywne inhibitory JAK1/JAK2, tofacitinib – nieselektywny inhibitor JAK 1/3, delgocitinib – inhibitor JAK 1, 2, 3 i TYK2, cerdulatinib oraz gusacitinib – selektywne inhibitory JAK i SYK.
Pierwszym lekiem z tej grupy zarejstrowanym w Europie do leczenia postaci umiarkowanej i ciężkiej AZS u dorosłych, którzy są kandydatami do terapii ogólnej, jest baricitinib. To selektywne inhibitory JAK1/JAK2. Podawany jest doustnie w dawce 4 mg i 2 mg na dobę. Baricitinib badany w grupie dorosłych z umiarkowanym i ciężkim AZS poprawił kliniczne objawy przedmiotowe i podmiotowe i powodował szybkie zmniejszenie świądu [101, 102].
Jak wykazały badania III fazy, monoterapia abrocitinibem raz na dobę była skuteczna i dobrze tolerowana u młodzieży od 12. roku życia i dorosłych z umiarkowanym i ciężkim atopowym zapaleniem skóry [100]. Przedstawiono już wyniki fazy IIb dla upadacitinibu, który był podawany doustnie jak dwa poprzednie leki [103]. Wyniki po czterech tygodniach terapii miejscowej tofacitinibem wykazały znacznie większą skuteczność kliniczną leku niż placebo z wczesnym początkiem działania (poprawa w zakresie świądu obserwowana już po dwóch dniach terapii) [104]. Ruxolitinib oceniono u dorosłych z łagodnym i umiarkowanym AZS. Obserwowano szybkie ustępowanie świądu w ciągu 36 godzin leczenia, poprawę jakości życia z jednoczesną dobrą tolerancją leku [105]. Delgocitinib jest na etapie III fazy badania prowadzonego u 158 japońskich pacjentów w wieku od 16. roku życia z umiarkowanym i ciężkim AZS, u których 0,5-proc. delgocitinib w maści stosowany przez okres 28 tygodni był skuteczny i dobrze tolerowany [106].
Sądząc po zaawansowaniu badań klinicznych i ich zakresie, należy się spodziewać i mieć nadzieję, że leki te w nieodległej przyszłości wzbogacą możliwości terapeutyczne AZS.
Terapia psychologiczna
Jak wiadomo, komponenta psychiczna i emocjonalna mają bardzo duży wpływ na przebieg AZS. Pacjenci z AZS są obarczeni wyższym ryzykiem rozwoju lęku i depresji [106]. Młodzież z AZS jest bardziej narażona na zaburzenia psychiczne, w tym myśli i zachowania samobójcze [107]. Pacjenci z AZS są mniej aktywni towarzysko, mają mniej przyjaciół. Choroba prowadzi do ich izolacji społecznej, problemów w pracy, szkole [108]. W leczeniu AZS bardzo istotna i niedoceniana jest rola interwencji psychologiczno-psychiatrycznych.
Podsumowanie
Atopowe zapalenie skóry to choroba o złożonej patogenezie, wymagająca wielowymiarowego oraz holistycznego podejścia, jak również zindywidualizowanego planu terapii. Ze względu na przewlekły i nawrotowy charakter znacząco przyczynia się do pogorszenia jakości życia pacjentów oraz zwiększenia nakładów finansowych związanych z częstymi hospitalizacjami. Terapia zawiera w sobie nie tylko leczenie zaostrzeń, lecz także kontrolę choroby w okresie pozornej remisji. W postępowaniu z AZS należy dążyć do terapii spersonalizowanej. Leczenie AZS to strategia. Rozpoczyna się od edukacji pacjenta, ustalenia dokładnego planu leczenia i niejednokrotnie wymaga interdyscyplinarnego wsparcia, w tym psychologicznego.
Piśmiennictwo
- Asher M.I., Montefort S., Björkstén B. et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. ISAAC Phase Three Study Group. Lancet 2006 Aug 26; 368 (9537): 733–743.
- Mortz C.G., Andersen K.E., Dellgren C. et al. Atopic dermatitis from adolescence to adulthood in the TOACS cohort: prevalence, persistence and comorbidities. Allergy 2015; 70: 836–845.
- Dalgard F.J., Gieler U., Tomas-Aragones L. et al. The psychological burden of skin diseases: a cross-sectional multicenter study among dermatological out-patients in 13 European countries. J Invest Dermatol 2015; 135: 984–991.
- Silverberg J.I. Comorbidities and the impact of atopic dermatitis. Ann Allergy Asthma Immunol 2019 Aug; 123 (2): 144–151
- Boguniewicz M., Leung D.Y.M. Atopic dermatitis: A disease of altered skin barrier and immune dysregulation. Immunol. Rev 2011. Doi: 10.1111/j.1600-065X.2011.01027.x.
- Čepelak I., Dodig S., Pavić I. Filaggrin and atopic march. Biochem Medica 2019; 29: 20501.
- Palmer C.N.A., Irvine A.D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat Genet 2006. Doi: 10.1038/ng1767.
- Klonowska J., Gleń J., Nowicki R.J. et al. New cytokines in the pathogenesis of atopic dermatitis – New therapeutic targets. International Journal of Molecular Sciences 2018. Doi: 10.3390/ijms19103086.
- Howell M.D., Kim B.E., Gao P. et al. Cytokine modulation of atopic dermatitis filaggrin skin expression. J Allergy Clin Immunol 2007; 120: 150–155.
- Trzeciak M., Sakowicz-Burewicz M., Wesserling M. et al. Expression of cornified envelope proteins in skin and its relationship with atopic dermatitis phenotype. Acta Derm Venereol 2017; 97: 36–41.
- Bäsler K., Bergmann S., Heisig M. et al. The role of tight junctions in skin barrier function and dermal absorption. J Control Release 2016; 242: 105–118.
- Gittler J.K., Shemer A., Suárez-Fariñas M. et al. Progressive activation of T(H)2/T(H)22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol 2012; 130: 1344–1354.
- Noda S. Suárez-Fariñas M., Ungar B. The Asian atopic dermatitis phenotype combines features of atopic dermatitis and psoriasis with increased TH17 polarization. J Allergy Clin Immunol 2015 Nov; 136 (5): 1254–1264.
- Brunner P.M., Israel A., Zhang N. et al. Early-onset pediatric atopic dermatitis is characterized by T2/T17/T22-centered inflammation and lipid alterations. J Allergy Clin Immunol 2018 Jun; 141 (6): 2094–2106.
- Kong H.H., Oh J., Deming C. et al. Temporal shifts in the skin microbiome associated with disease flares and treatment in children with atopic dermatitis. Genome Res 2012 May; 22 (5): 850–859.
- Paller A.S., Kong H.H., Seed P. et al. The microbiome in patients with atopic dermatitis. JACI 2019; 143 (1): 26–35.
- Alexander H.. Paller A.S., Traidl-Hoffmann C. et al. The role of bacterial skin infections in atopic dermatitis: expert statement and review from the International Eczema Council Skin Infection Group. Br J Dermatol 2019 Nov 1. Doi: 10.1111/bjd.18643.
- Nowicki R.J., Trzeciak M., Kaczmarski M. et al. Atopic dermatitis. Interdisciplinary diagnostic and therapeutic recommendations of the Polish Dermatological Society, Polish Society of Allergology, Polish Pediatric Aociety and Polish Aociety of Family Medicine. Part I. Prophylaxis, topical treatment and phototherapy. Przegl Dermatol 2019. Doi: 10.5114/dr.2019.88253.
- Nowicki R., Trzeciak M., Kaczmarski M. et al. Atopic dermatitis. Interdisciplinary diagnostic and therapeutic recommendations of the Polish Dermatological Society, Polish Society of Allergology, Polish Pediatric Society and Polish Society of Family Medicine. Part II. Systemic treatment and new therapeutic methods. Dermatology Rev 2019; 106: 475–485.
- ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children. Wollenberg A, Christen-Zäch S, Taieb A, Paul C, Thyssen JP, de Bruin-Weller M, Vestergaard C, Seneschal J, Werfel T, Cork MJ, Kunz B, Fölster-Holst R, Trzeciak M, Darsow U, Szalai Z, Deleuran M, von Kobyletzki L, Barbarot S, Heratizadeh A, Gieler U, Hijnen DJ, Weidinger S, De Raeve L, Svensson Å, Simon D, Stalder JF, Ring J; European Task Force on Atopic Dermatitis/EADV Eczema Task Force. J Eur Acad Dermatol Venereol. 2020 Dec;34(12):2717-2744.
- Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol 2018 May; 32 (5): 657–682.
- Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol 2018 Jun; 32 (6): 850–878.
- Staab D., Diepgen T.L., Fartasch M. et al. Age related, structured educational programmes for the management of atopic dermatitis in children and adolescents: multicentre, randomised controlled trial. Br Med J 2006. Doi: 10.1136/bmj.332.7547.933.
- Angelova-Fischer I., Dapic I., Hoek A.K. et al. Skin barrier integrity and natural moisturising factor levels after cumulative dermal exposure to alkaline agents in atopic dermatitis. Acta Derm Venereol 2014. Doi: 10.2340/00015555-1815.
- Miyahara R. Emollients. In: Cosmetic Science and Technology: Theoretical Principles and Applications. 2017, pp. 245–253. Doi: 10.1016/B978-0-12-802005-0.00016-1.
- Lacarrubba F. Corticosteroid Cream Once Daily plus an Emollient Cream in comparison with Corticosteroid Cream Twice Daily in Plaque Psoriasis: An Intra- Patient, Randomized Assessor-Blinded, Ultrasound Evaluation Study. J Clin Exp Dermatol Res 2014; 05. Doi: 10.4172/2155-9554.1000243.
- Majewski S., Bhattacharya T., Asztalos M. et al. Sodium hypochlorite body wash in the management of Staphylococcus aureus–colonized moderate-to-severe atopic dermatitis in infants, children, and adolescents. Pediatr Dermatol 2019. Doi: 10.1111/pde.13842.
- Queille C., Pommarede R., Saurat J.H. Efficacy Versus Systemic Effects of Six Topical Steroids in the Treatment of Atopic Dermatitis of Childhood. Pediatr Dermatol 1984. Doi: 10.1111/j.1525-1470.1984.tb01124.x.
- Walsh P., Aeling J.L., Huff L. et al. Hypothalamus-pituitary-adrenal axis suppression by superpotent topical steroids. J Am Acad Dermatol 1993. Doi: 10.1016/S0190-9622(08)82011-7.
- Hengge U.R., Ruzicka T., Schwartz R.A. et al. Adverse effects of topical glucocorticosteroids. Journal of the American Academy of Dermatology 2006. Doi: 10.1016/j.jaad.2005.01.010.
- Roeder A., Schaller M., Schäfer-Korting M. et al. Safety and efficacy of fluticasone propionate in the topical treatment of skin diseases. Skin Pharmacology and Physiology 2005. Doi: 10.1159/000081680.
- Stalder J.F., Aubert H., Anthoine E. et al. Multicenter Study Topical corticosteroid phobia in atopic dermatitis: International feasibility study of the TOPICOP score. Allergy 2017 Nov; 72 (11): 1713–1719. Doi: 10.1111/all.13189. Epub 2017 May 22.
- Chen S.L., Yan J., Wang F.S. Two topical calcineurin inhibitors for the treatment of atopic dermatitis in pediatric patients: A meta-analysis of randomized clinical trials. J. Dermatolog Treat 2010. Doi: 10.3109/09546630903401470.
- Ruzicka T., Bieber T., Schöpf E. et al. A short-term trial of tacrolimus ointment for atopic dermatitis. N Engl J Med 1997. Doi: 10.1056/NEJM199709183371203.
- Reitamo S., Wollenberg A., Schöpf E. et al. Safety and efficacy of 1 year of tacrolimus ointment monotherapy in adults with atopic dermatitis. Arch. Dermatol 2000. Doi: 10.1001/archderm.136.8.9.
- Luger T., Boguniewicz M., Carr W. et al. Pimecrolimus in atopic dermatitis: Consensus on safety and the need to allow use in infants. Pediatr Allergy Immunol 2015; 26: 306–315.
- Meurer M., Fartasch M., Albrecht G. et al. Long-term efficacy and safety of pimecrolimus cream 1% in adults with moderate atopic dermatitis. Dermatology 2004; 208: 365–372.
- Reitamo S., Van Leent E.J., Ho V. et al. Efficacy and safety of tacrolimus ointment compared with that of hydrocortisone acetate ointment in children with atopic dermatitis. J Allergy Clin Immunol 2002; 109: 539–546.
- Retime S., Rustin M., Harper J. et al. A 4-year follow-up study of atopic dermatitis therapy with 0.1% tacrolimus ointment in children and adult patients. Br J Dermatol 2008; 159: 942–951.
- Sigurgeirsson B., Boznanski A., Todd G. et al. Safety and efficacy of pimecrolimus in atopic dermatitis: a 5-year randomized trial. Pediatrics 2015; 135: 597–606.
- Apples: A prospective pediatric longitudinal evaluation to assess the long-term safety of tacrolimus ointment for the treatment of atopic dermatitis. J Am Acad Dermatol 2007. Doi: 10.1016/j.jaad.2006.10.064.
- Wollenberg A., Bieber T. Proactive therapy of atopic dermatitis – An emerging concept. Allergy: European Journal of Allergy and Clinical Immunology 2009. Doi: 10.1111/j.1398-9995.2008.01803.x.
- Wollenberg A., Reitamo S., Atzori F. et al. Proactive treatment of atopic dermatitis in adults with 0.1% tacrolimus ointment. Allergy 2008; 63: 742–750.
- Thaci D., Reitamo S., Gonzalez Ensenat M.A. et al. Proactive disease management with 0.03% tacrolimus ointment for children with atopic dermatitis: results of a randomized, multicentre, comparative study. Br J Dermatol 2008; 159: 1348–1356.
- Zane L.T., Kircik L., Call R. et al. Crisaborole topical ointment, 2% in patients ages 2 to 17 years with atopic dermatitis: A phase 1b, open-label, maximal-use systemic exposure study. Pediatr Dermatol 2016. Doi: 10.1111/pde.12872.
- Paller A.S., Tom W.L., Lebwohl M.G. et al. Efficacy and safety of crisaborole ointment, a novel, nonsteroidal phosphodiesterase 4 (PDE4) inhibitor for the topical treatment of atopic dermatitis (AD) in children and adults. J Am Acad Dermatol 2016. Doi: 10.1016/j.jaad.2016.05.046.
- Shaughnessy C.N., Malajian D., Belsito D.V. Cutaneous delayed-type hypersensitivity in patients with atopic dermatitis: Reactivity to topical preservatives. J Am Acad Dermatol 2014. Doi: 10.1016/j.jaad.2013.08.046.
- Chrostowska-Plak D., Reich A., Szepietowski J.C. Relationship between itch and psychological status of patients with atopic dermatitis. J Eur Acad Dermatology Venereol 2013. Doi: 10.1111/j.1468-3083.2012.04578.x.
- Sher L.G., Chang J., Patel I.B. et al. Relieving the pruritus of atopic dermatitis: A meta-analysis. Acta Dermato-Venereologica 2012. Doi: 10.2340/00015555-1360.
- Hauss H., Proppe A., Matthies C. Vergleichende Untersuchungen zur Behandlung von trockener, juckender Haut mit einer Zubereitung aus Harnstoff und Polidocanol sowie mit einer Linolsaure-haltigen Fettcreme. Ergebnisse aus der Praxis. Dermatosen Beruf und Umwelt 1993; 41 (5): 184–188.
- Diepgen TL. Early Treatment of the Atopic Child Study G. Long-term treatment with cetirizine of infants with atopic dermatitis: a multi-coun- try, double-blind, randomized, placebo-controlled trial (the ETAC trial) over 18 months. Pediatr Allergy Immunol 2002; 13: 278–286.
- Schommer A., Matthies C., Petersen I. et al. Effektivität einer Polidocanol-Harnstoff-Kombination bei trockener, juckender Haut: Ergebnisse einer methodisch geprüften Anwendungsbeobachtung. Aktuelle Derm 2007. Doi: 10.1055/s-2006-945179.
- Weisshaar E., Forster C., Dotzer M. et al. Experimentally induced pruritus and cutaneous reactions with topical antihistamine and local analgesics in atopic eczema. Skin Pharmacol Physiol 1997. Doi: 10.1159/000211503.
- Weisshaar E., Heyer G., Forster C. et al. Effect of topical capsaicin on the cutaneous reactions and itching to histamine in atopic eczema compared to healthy skin. Arch Dermatol Res 1998. Doi: 10.1007/s004030050309.
- Lysy J., Sistiery-Ittah M., Israelit Y. et al. Topical capsaicin – A novel and effective treatment for idiopathic intractable pruritus ani: A randomised, placebo controlled, crossover study. Gut 2003. Doi: 10.1136/gut.52.9.1323.
- Reimann S., Luger T., Metze D. [Topical administration of capsaicin in dermatology for treatment of itching and pain]. Hautarzt 2000. Doi: 10.1007/s001050051014.
- Cornelissen C., Marquardt Y., Czaja K. et al. IL-31 regulates differentiation and filaggrin expression in human organotypic skin models. J Allergy Clin Immunol 2012. Doi: 10.1016/j.jaci.2011.10.042.
- Schlievert P.M., Case L.C., Strandberg K.L. et al. Superantigen profile of Staphylococcus aureus isolates from patients with steroid-resistant atopic dermatitis. Clin Infect Dis 2008. Doi: 10.1086/586746.
- Park S.H., Kim J.K., Park K. In Vitro Antimicrobial Activities of Fusidic Acid and Retapamulin against Mupirocin- and Methicillin-Resistant Staphylococcus aureus. Ann Dermatol 2015; 27: 551–556.
- Bath-Hextall F.J., Birnie A.J., Ravenscroft J.C. et al. Interventions to reduce Staphylococcus aureus in the management of atopic eczema: An updated Cochrane review. British Journal of Dermatology 2010. Doi: 10.1111/j.1365-2133.2010.09743.x.
- Chiu L.S., Chow V.C.Y., Ling J.M.L. et al. Staphylococcus aureus carriage in the anterior nares of close contacts of patients with atopic dermatitis. Arch Dermatol 2010. Doi: 10.1001/archdermatol.2010.129.
- Wollenberg A., Zoch C., Wetzel S. et al. Predisposing factors and clinical features of eczema herpeticum: A retrospective analysis of 100 cases. J Am Acad Dermatol 2003. Doi: 10.1067/S0190-9622(03)00896-X.
- Glatz M., Bosshard P., Hoetzenecker W. et al. The Role of Malassezia spp. in atopic dermatitis. J Clin Med 2015. Doi: 10.3390/jcm4061217.
- Kim T.Y., Jang I.G., Park Y.M. et al. Head and neck dermatitis: The role of Malassezia furfur, topical steroid use and environmental factors in its causation. Clin Exp Dermatol 1999. Doi: 10.1046/j.1365-2230.1999.00460.x.
- Svejgaard E., Ølholm Larsen P., Deleuran M. et al. Treatment of head and neck dermatitis comparing itraconazole 200 mg and 400 mg daily for 1 week with placebo. J Eur Acad Dermatology Venereol 2004. Doi: 10.1111/j.1468-3083.2004.00963.x.
- Gambichler T., Kreuter A., Tomi N.S. et al. Gene expression of cytokines in atopic eczema before and after ultraviolet A1 phototherapy. Br J Dermatol 2008. Doi: 10.1111/j.1365-2133.2008.08498.x.
- Dotterud L.K., Wilsgaard T., Vorland L.H. et al. The effect of UVB radiation on skin microbiota in patients with atopic dermatitis and healthy controls. Int J Circumpolar Health 2008. Doi: 10.3402/ijch.v67i2-3.18282.
- Placek W., Kaszuba A., Lesiak A. et al. Phototherapy and photochemotherapy in dermatology. Recommendations of the Polish Dermatological Society. Dermatology Rev 2019; 106: 237–256.
- Oranje A.P. Evidence-based pharmacological treatment of atopic dermatitis: An expert opinion and new expectations. Indian Journal of Dermatology 2014. Doi: 10.4103/0019-5154.127673.
- Devillers A.C.A., Oranje A.P. Wet-wrap treatment in children with atopic dermatitis: A practical guideline. Pediatric Dermatology 2012. Doi: 10.1111/j.1525-1470.2011.01691.x.
- Oranje A.P., Devillers A.C.A., Kunz B. et al. Treatment of patients with atopic dermatitis using wet-wrap dressings with diluted steroids and/or emollients. An expert panel’s opinion and review of the literature. Journal of the European Academy of Dermatology and Venereology 2006. Doi: 10.1111/j.1468-3083.2006.01790.x.
- Lee J.H., Lee S.J., Kim D.S. et al. The effect of wet-wrap dressing on epidermal barrier in patients with atopic dermatitis. J Eur Acad Dermatology Venereol 2007. Doi: 10.1111/j.1468-3083.2007.02277.x.
- Devillers A.C.A., Oranje A. P. Efficacy and safety of ‘wet-wrap’ dressings as an intervention treatment in children with severe and/or refractory atopic dermatitis: A critical review of the literature. British Journal of Dermatology 2006. Doi: 10.1111/j.1365-2133.2006.07157.x.
- Goodyear H.M., Spowart K., Harper J.I. ‘Wet-wrap’ dressings for the treatment of atopic eczema in children. British Journal of Dermatology 1991. Doi: 10.1111/j.1365-2133.1991.tb14807.x.
- Oranje A.P., Wolkerstorfer A., De Waard-van der Spek F.B. Treatment of erythrodermic atopic dermatitis with ‘wet-wrap’ fluticasone propionate 0.05% cream/emollient 1:1 dressings. Journal of Dermatological Treatment 1999. Doi: 10.3109/09546639909055916.
- Knierer W. Dermatologie und Venerologie. Munch Med Wochenschr 1952. Doi: 10.1097/00000441-196602000-00031.
- Tajima K., Amakawa R., Ito T. et al. Immunomodulatory effects of cyclosporin A on human peripheral blood dendritic cell subsets. Immunology 2003; 108: 321–328.
- Garrido Colmenero C., Blasco Morente G.,Tercedor Sánchez J. Oral Cyclosporine Weekend Therapy: A New Maintenance Therapeutic Option in Patients with Severe Atopic Dermatitis. Pediatr Dermatol 2015; 32: 551–552.
- Weatherhead S.C., Wahie S., Reynolds N.J. et al. An open-label, dose-ranging study of methotrexate for moderate-to-severe adult atopic eczema. Br J Dermatol 2007. Doi: 10.1111/j.1365-2133.2006.07686.x.
- Berth-Jones J., Takwale A., Tan E. et al. Azathioprine in severe adult atopic dermatitis: A double-blind, placebo-controlled, crossover trial. Br J Dermatol 2002. Doi: 10.1046/j.1365-2133.2002.04989.x.
- Sanderson J.D. TPMT Testing Before Starting Azathioprine or Mercaptopurine: Surely Just Do It? Gastroenterology 2015; 149: 850–853.
- Haeck I.M., Knol M.J., Berge O.T. et al. Enteric-coated mycophenolate sodium versus cyclosporin a as long-term treatment in adult patients with severe atopic dermatitis: A randomized controlled trial. J Am Acad Dermatol 2011. Doi: 10.1016/j.jaad.2010.04.027.
- Czarnowicki T., He H., Krueger J.G. et al. Atopic dermatitis endotypes and implications for targeted therapeutics. Journal of Allergy and Clinical Immunology 2019. Doi: 10.1016/j.jaci.2018.10.032.
- Thaçi D., Simpson E.L., Beck L.A. et al. Efficacy and safety of dupilumab in adults with moderate-to-severe atopic dermatitis inadequately controlled by topical treatments: A randomised, placebo-controlled, dose-ranging phase 2b trial. Lancet 2016. Doi: 10.1016/S0140-6736(15)00388-8.
- Blauvelt A., de Bruin-Weller M., Gooderham M. et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet 2017. Doi: 10.1016/S0140-6736(17)31191-1.
- Thaçi D., Simpson E.L., Deleuran M. et al. Efficacy and safety of dupilumab monotherapy in adults with moderate-to-severe atopic dermatitis: a pooled analysis of two phase 3 randomized trials (LIBERTY AD SOLO 1 and LIBERTY AD SOLO 2). J Dermatol Sci 2019. Doi: 10.1016/j.jdermsci.2019.02.002.
- Barbarot S., Wollenberg A., Silverberg J.I. et al. Dupilumab provides rapid and sustained improvement in SCORAD outcomes in adults with moderate-to-severe atopic dermatitis: combined results of four randomized phase 3 trials. J Dermatolog Treat 2020. Doi: 10.1080/09546634.2020.1750550.
- Simpson E.L., Paller A.S., Siegfried E.C. et al. Efficacy and Safety of Dupilumab in Adolescents With Uncontrolled Moderate to Severe Atopic Dermatitis: A Phase 3 Randomized Clinical Trial. JAMA Dermatol 2020 Jan 1; 156 (1): 44–56.
- Cork M.J., Thaçi D., Eichenfield L.F. et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension. Br J Dermatol 2020 Jan; 182 (1): 85–96.
- Silverberg J.I., Yosipovitch G., Simpson E.L. et al. Dupilumab treatment results in early and sustained improvements in itch in adolescents and adults with moderate to severe atopic dermatitis: Analysis of the randomized phase 3 studies SOLO 1 and SOLO 2, AD ADOL, and CHRONOS. J Am Acad Dermatol 2020 Jun; 82 (6): 1328–1336.
- Paller A.S., Siegfried E.C., Thaçi D. et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol 2020 Nov; 83 (5): 1282–1293.
- Paller A.S., Siegfried E.C., Simpson E.L. et al. A phase 2, open-label study of single dose dupilumab in children aged 6 months to <6 years with severe uncontrolled atopic dermatitis: pharmacokinetics, safety and efficacy. J Eur Acad Dermatol Venereol 2020 Sep 7. Doi: 10.1111/jdv.16928.
- Simpson E.L., Flohr C., Eichenfield L.F. et al. Efficacy and safety of lebrikizumab (an anti-IL-13 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by topical corticosteroids: A randomized, placebo-controlled phase II trial (TREBLE). J Am Acad Dermatol 2018. Doi: 10.1016/j.jaad.2018.01.017.
- Wollenberg A., Howell M.D., Guttman-Yassky E. et al. Treatment of atopic dermatitis with tralokinumab, an anti–IL-13 mAb. J Allergy Clin Immunol 2019. Doi: 10.1016/j.jaci.2018.05.029.
- Silverberg J.I., Pinter A., Pulka G. et al. Phase 2B randomized study of nemolizumab in adults with moderate-to-severe atopic dermatitis and severe pruritus. J Allergy Clin Immunol 2020. Doi: 10.1016/j.jaci.2019.08.013.
- Kabashima K., Furue M., Hanifin J. et al. 005 Humanized anti-interleukin-31 receptor A antibody nemolizumab (CIM331) suppresses pruritus and improves eczema in patients with moderate-to-severe atopic dermatitis. J Invest Dermatol 2016. Doi: 10.1016/j.jid.2016.06.022.
- Chen Y.L., Gutowska-Owsiak D., Hardman C.S. et al. Proof-of-concept clinical trial of etokimab shows a key role for IL-33 in atopic dermatitis pathogenesis. Sci Transl Med 2019. Doi: 10.1126/scitranslmed.aax2945.
- Guttman-Yassky E., Brunner P.M., Neumann A.U. et al. Efficacy and safety of fezakinumab (an IL-22 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by conventional treatments: A randomized, double-blind, phase 2a trial. J Am Acad Dermatol 2018. Doi: 10.1016/j.jaad.2018.01.016.
- Simpson E.L., Parnes J.R., She D. et al. Tezepelumab, an anti-thymic stromal lymphopoietin monoclonal antibody, in the treatment of moderate to severe atopic dermatitis: A randomized phase 2a clinical trial. J Am Acad Dermatol 2019. Doi: 10.1016/j.jaad.2018.11.059.
- Simpson E.L., Sinclair R., Forman S. et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet 2020; 396 (10246): 255–266.
- Simpson E.L., Lacour J.P., Spelman L. et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials. Br J Dermatol 2020; 183 (2): 242–255.
- Guttman-Yassky E., Silverberg J.I., Nemoto O. et al. Baricitinib in adult patients with moderate-to-severe atopic dermatitis: A phase 2 parallel, double-blinded, randomized placebo-controlled multiple-dose study. J Am Acad Dermatol 2019. Doi: 10.1016/j.jaad.2018.01.018.
- Guttman-Yassky E., Thaçi D., Pangan A.L. et al. Upadacitinib in adults with moderate to severe atopic dermatitis: 16-week results from a randomized, placebo-controlled trial. J Allergy Clin Immunol 2020. Doi: 10.1016/j.jaci.2019.11.025.
- Bissonnette R., Papp K.A., Poulin Y. et al. Topical tofacitinib for atopic dermatitis: a phase IIa randomized trial. Br J Dermatol 2016; 175 (5): 902–911.
- Kim B.S., Sun K., Papp K. et al. Effects of ruxolitinib cream on pruritus and quality of life in atopic dermatitis: Results from a phase 2, randomized, dose-ranging, vehicle- and active-controlled study. J Am Acad Dermatol 2020; 82 (6): 1305–1313.
- Nakagawa H., Nemoto O., Igarashi A. et al. Efficacy and safety of topical JTE-052, a Janus kinase inhibitor, in Japanese adult patients with moderate-to-severe atopic dermatitis: a phase II, multicentre, randomized, vehicle-controlled clinical study. Br J Dermatol 2018. Doi: 10.1111/bjd.16014.
- Cheng C.M., Hsu J.W., Huang K.L. et al. Risk of developing major depressive disorder and anxiety disorders among adolescents and adults with atopic dermatitis: a nationwide longitudinal study. J Affect Disord 2015; 178: 60–65.
- Halvorsen J.A., Lien L., Dalgard F. et al. Suicidal ideation, mental health problems, and social function in adolescents with eczema: A population-based study. J Invest Dermatol 2014. Doi: 10.1038/jid.2014.70.
- Xie Q.W., Xiaolu D., Tang X., et al. Risk of mental disorders in children and adolescents with atopic dermatitis: A systematic review and meta-analysis. Frontiers in Psychology 2019. Doi: 10.3389/fpsyg.2019.01773.