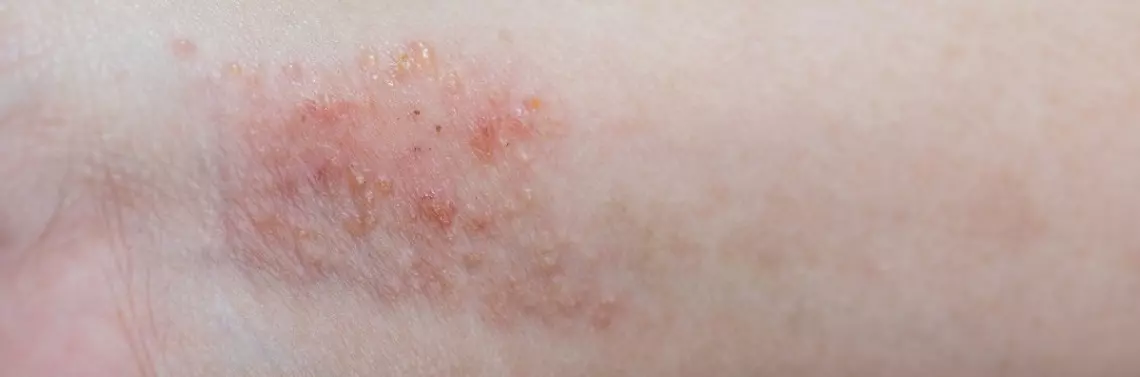
Atopowe zapalenie skóry (AZS) to dermatoza wymagająca przewlekłej terapii, w której bezsprzeczną rolę odgrywają leki aplikowane miejscowo. Obok tzw. terapii podstawowej, którą stanowią emolienty odbudowujące zaburzoną barierę skórno-naskórkową, lekami pierwszego rzutu są miejscowo stosowane glikokortykosteroidy (mGKS) i inhibitory kalcyneuryny (mIK). Glikokortykosteroidy wykazują silne działanie przeciwzapalne, a tym samym nadają się do szybkiego ograniczenia zaostrzeń choroby. Jednak powszechnie znane działania niepożądane mGKS (m.in. działanie atrofogenne) w obliczu korzystnego profilu działania mIK skłaniają dermatologów do stosowania tej ostatniej grupy leków zarówno u dorosłych, jak i u dzieci. Dostępne dane potwierdzają, że mIK są skuteczne i dobrze tolerowane także w terapii długofalowej (m.in. proaktywnej), a dzięki potencjałowi zmniejszającemu liczbę nawrotów znacząco poprawiają jakość życia pacjentów. Zgodnie z dotychczasowa wiedzą – prawidłowo stosowane nie ulegają absorpcji, tym samym nie wykazują systemowego działania immunosupresyjnego [1].
Mechanizm działania mIK różni się od mGKS. Inhibitory kalcyneuryny hamują aktywację limfocytów i mastocytów i zapobiegają nasileniu stanu zapalnego modulowanego cytokinami prozapalnymi, odbudowując jednocześnie barierę skórno-naskórkową. Zgodnie z dostępnymi wynikami badań, siła działania np. 0,1-procentowego takrolimusu jest porównywalna z siłą działania mGKS średniej mocy, a zgodnie z doniesieniami Svensona i wsp. oraz Reitamo i wsp. nawet z mGKS o najwyższej sile działania [2, 3]. Zaletą mIK jest zdolność do ograniczania świądu poprzez desynsytyzację neuronów czuciowych [4, 5] oraz samego stanu zapalnego o etiologii neurogennej [6].
Leki te oczywiście nie są w stanie wyprzeć mGKS z procesu terapeutycznego w AZS. Co więcej, ostatnie badania in vitro wykazują, że z powodu różnic w mechanizmach działania należy rozważać łączenie obu grup leków w terapii w celu uzyskania efektu synergistycznego [7].
Z działań niepożądanych mIK znane jest przejściowe pieczenie po ich włączeniu wynikające z aktywacji nocyceptorów TRPV1, ustępujące po systematycznej aplikacji. Obawiano się wyższej częstości infekcji podczas stosowania mI...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.