Choroby gronkowcowe skóry to wciąż aktualny problem. Skórne objawy infekcji mogą wynikać zarówno z bezpośredniej obecności bakterii, jak i z działania toksyn produkowanych przez Staphylococcus aureus (S. aureus), tj. Panton–Valentine leukocydyny (PVL), eksfoliatyn (ETs), enterotoksyn, toksyny zespołu wstrząsu toksycznego (TSST-1, ang. toxic shock syndrome toxin-1). Do chorób gronkowcowych należą m.in. liszajec zakaźny, zapalenie mieszków włosowych, czyraki, zespół SSSS, a także mniej znana botriomykoza [1].
POLECAMY
Liszajec zakaźny
To infekcja powodowana przez S. aureus, Streptococcus pyogenes lub oba patogeny. Co ciekawe, gronkowiec dominuje w krajach rozwiniętych, a paciorkowiec w krajach rozwijających się. Choroba dotyczy głównie dzieci. Ponieważ jest zakaźna, często dochodzi do autoinokulacji, jak również zakażeń wśród członków rodziny [2–6].
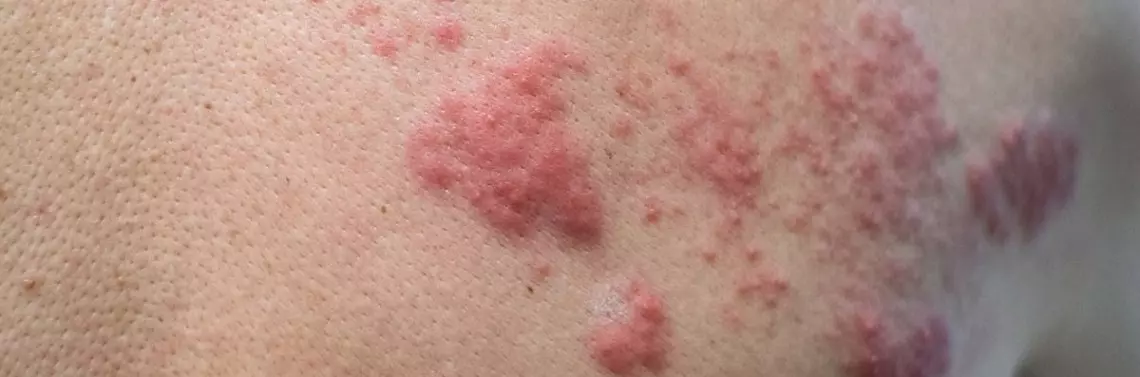
Rozpoznanie można postawić już na podstawie obrazu klinicznego. W liszajcu gronkowcowym wykwitem pierwotnym jest pęcherz wypełniony ropą (zdj. 1), pokrywa pęcherza łatwo spełza, pozostawiając nadżerkę pokrytą strupem.
Najczęściej u dzieci choroba rozpoczyna się w okolicy ust, ale może wystąpić od początku w każdej lokalizacji. Zgrupowania licznych zmian mogą tworzyć policykliczne formy. Stan ogólny pacjenta jest dobry, bez gorączki, czasem dochodzi do limfadenopatii – zajęte są węzły chłonne, do których spływa chłonka z zakażonych obszarów skóry.
Opisano kilka wariantów liszajca: krostkowy, suchy i liszajec noworodków, nazywany dawniej pęcherzycą noworodków. Należy pamiętać o zliszajcowaceniu – nadkażeniu bakteryjnym innej jednostki chorobowej,
tj. wyprysku, opryszczki i innych, czasem będącym efektem drapania, np. we wszawicy i w świerzbie. U podłoża infekcji leżą eksfoliatyny A i B. Celem eksfoliatyn jest demogleina I odpowiadająca za wzajemne przyleganie keratynocytów górnych warstw naskórka [2, 10–12]. Działanie eksfoliatyn prowadzi do rozdzielenia keratynocytów, czego efektem jest powstanie pęcherza. Pęcherze nie są typowe dla infekcji Streptococcus pyogenes, ale mechanizm powstania zmian jest podobny, z tym że w tym przypadku główną rolę odgrywa paciorkowcowa egzotoksyna B (Spe-B, ang. streptococcal pyrogenic exotoxin) tnąca pozakomórkowe domeny desmogleiny 1 i 3 [13].
Zgodnie z doniesieniami literaturowymi leczenie miejscowe mupirocyną i kwasem fusydowym jest tak s...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.