Wstęp
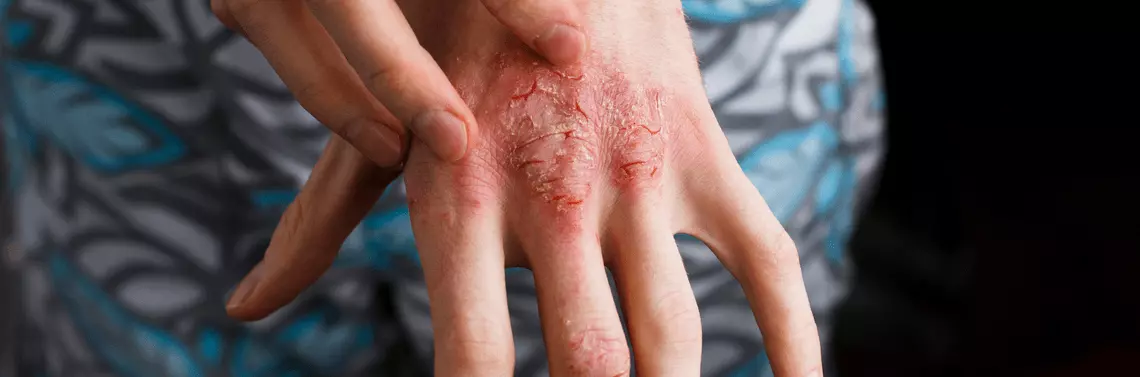
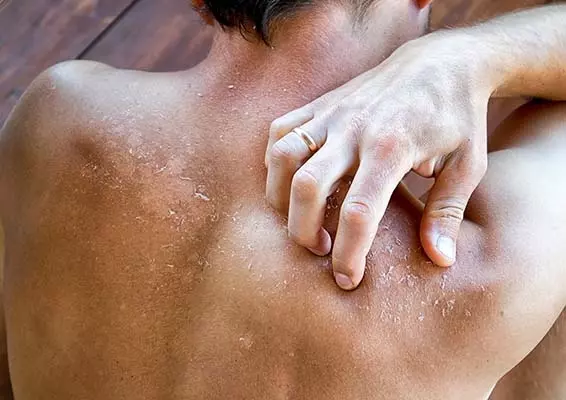
Protopic® jest miejscowym preparatem leczniczym dostępnym w postaci 0,03- lub 0,1-procentowej maści, zarejestrowanym w leczeniu umiarkowanych i ciężkich postaci atopowego zapalenia skóry (AZS) u dorosłych i dzieci (w wieku od 2 lat – 0,03% maść; powyżej 16. roku życia – stężenie 0,1%). Przeznaczony jest on do stosowania w przypadku braku dostatecznej odpowiedzi klinicznej na leczenie konwencjonalne, takie jak miejscowe stosowanie glikokortykosteroidów (mGKS) lub braku ich tolerancji [1]. Substancją aktywną leku jest takrolimus (FK 506), miejscowy małocząsteczkowy inhibitor kalcyneuryny z grupy laktonów makrolidowych, zawierający diketonamid związany z 23-członowym pierścieniem struktury hemiketalowej (C44H69NO12) [2].
Nazwa „tacrolimus” to akronim utworzony od słów Tskuba Macrolide Immunosuppressant, który ma swoje źródło w nazwie rodzajowej bakterii Streptomyces tskubaensis [3]. Takrolimus jest jednym z metabolitów tego promieniowca i został odkryty w 1984 r. przez japoński zespół Fujisawa Pharmaceutica Co. Obecnie jest on pozyskiwany w procesie modyfikacji chemicznej na drodze biosyntezy [4].
Mechanizm działania leku polega na wiązaniu się z białkiem FKBP-12, powstały kompleks hamuje aktywność zależnej od wapni...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.