Zmiany skórne powstałe w wyniku terapii ukierunkowanych molekularnie oraz immunologicznych stosowanych w onkologii mogą być spowodowane przynajmniej czterema czynnikami:
POLECAMY
- mechanizmem działania leku,
- nadwrażliwością na lek,
- wtórnymi zakażeniami związanymi ze spadkiem odporności,
- zaostrzeniem się istniejących uprzednio chorób skóry.
Artykuł dotyczy postępowania w powikłaniach skórnych w wybranych terapiach onkologicznych, takich jak:
- leczenie ukierunkowane na naskórkowy czynnik wzrostu (epidermal growth factor receptor – EGFR),
- leczenie ukierunkowane na zmutowany gen kodujący białko BRAF (białko o aktywności kinazy seroninowo-treoninowej),
- przeciwciała przeciwko inhibitorom punktów kontrolnych, takich jak: CTLA4 (cytotoxic T cell antigen 4), PD-1 (programmed death receptor 1), PD-L1 (ligand 1 dla receptora PD-1).
Leczenie ukierunkowane na naskórkowy czynnik wzrostu (przeciwciała anty-EGFR oraz inhibitory kinazy tyrozynowej EGFR)
Leczenie przeciwciałami ukierunkowanymi na receptor EGF w praktyce klinicznej opiera się przede wszystkim na dwóch lekach – cetuksymabie, który jest przeciwciałem monoklonalnym klasy IgG1 oraz panitumumabie, będącym w pełni ludzkim przeciwciałem monoklonalnym IgG2. Zarówno cetuksymab [1] i panitumumab [2] wykazują duże powinowactwo i specyficzność wobec receptora ludzkiego naskórkowego czynnika wzrostu (EGFR) i mają zastosowanie w leczeniu raka jelita grubego i nowotworów z regionu głowy i szyi [3].
Receptor EGF wpływa na szereg procesów zachodzących w naskórku, m.in. regulację proliferacji, różnicowanie, migrację i przeżycie komórek naskórka oraz nabłonków, przede wszystkim keratynocytów.
Zahamowanie aktywności EGFR prowadzi do:
- zaburzenia dojrzewania i odnowy naskórka,
- zapalenia mieszków włosowych o różnym stopniu nasilenia,
- nieprawidłowego rogowacenia w ujściach mieszków włosowych,
- wzrostu ryzyka nadkażenia bakteryjnego lub drożdżakowego skóry,
- ścieńczenia i łatwego podrażniania naskórka i błon śluzowych,
- indukcji stanu zapalnego stymulowanego chemokinami i aktywacji komórek odpowiedzi wrodzonej, takich jak: monocyty, neutrofile, makrofagi, które potęgują procesy uszkodzenia skóry.
W związku z rosnącą częstością stosowania leczenia ukierunkowanego na EGFR oraz na inne elementy szlaku EGFR → RAS⁄RAF⁄MEK⁄ERK, powstało pojęcie „RASopatie”, określające patologię skórną pojawiającą się w wyniku aktywacji wyżej wymienionego szlaku sygnałowego.
Częstość skórnych działań niepożądanych (RASopatii) po przeciwciałach anty-EGFR przedstawia się następująco:
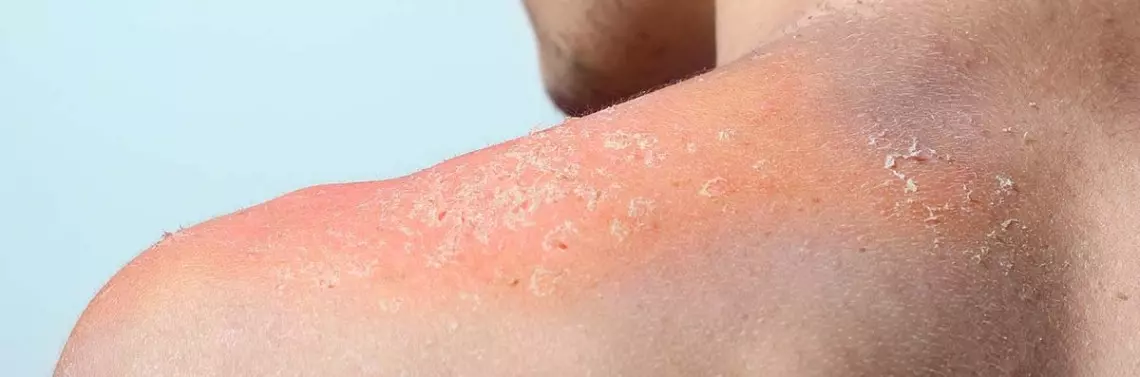
- Osutka grudkowo-krostkowa (trądzikopodobna), występująca najczęściej i najwcześniej (90% pacjentów) (zdj. 1).
- Zapalenie wałów okołopaznokciowych (16–58% pacjentów).
- Zmiany płytki paznokciowej (20% pacjentów).
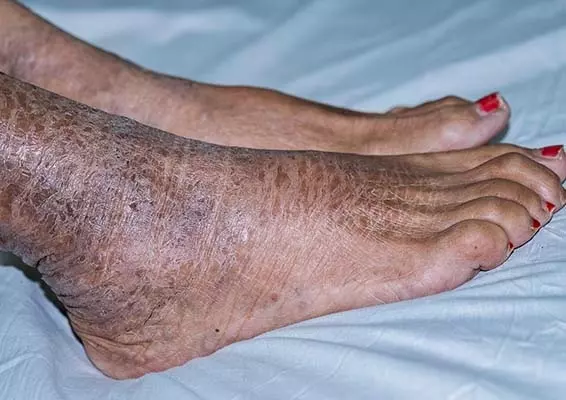
- Suchość skóry (do 30% pacjentów) (zdj. 2).
- Świąd skóry (10% pacjentów).
- Zajęcie błon śluzowych (11% pacjentów).
- Łysienie (5% pacjentów) lub zmiana struktury włosa (12% pacjentów).
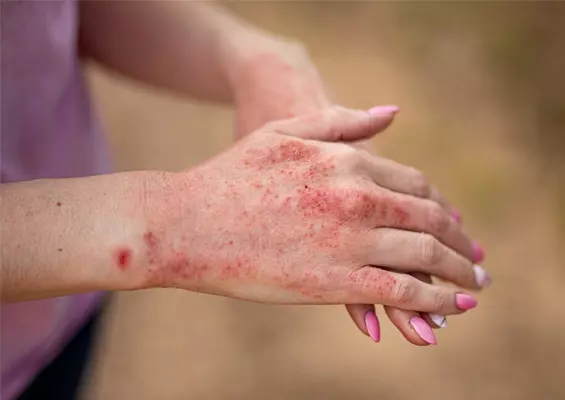
- Zespół ręka-stopa (18% pacjentów) (zdj. 3).

zaawansowanego raka jelita grubego


Mając wiedzę, że u większości pacjentów przyjmujących leczenie anty-EGFR pojawią się różnego rodzaju toksyczności skórne, należy równocześnie z rozpoczęciem leczenia onkologicznego rozpocząć działania profilaktyczne. Poniżej przedstawiono najważniejsze punkty, których należy przestrzegać podczas terapii anty-EGFR, aby minimalizować częstość wystąpienia i nasilenie powikłań skórnych:
- myć się w letniej wodzie (nie gorącej i nie zimnej),
- stosować krótki prysznic (nie długą kąpiel),
- myć skórę ręką bez szorowania gąbką lub szczotką,
- stosować łagodne preparaty do mycia niebędące mydłami (np. Cerkopil),
- delikatnie osuszać skórę ręcznikiem przez dotyk,
- stosować nawilżające i łagodzące szampony (np. produkty do skóry wrażliwej),
- unikać roztworów na bazie alkoholu, np. perfum,
- nosić wygodne obuwie,
- chronić skórę przed mrozem i wiatrem,
- stosować ochronę UV,
- nosić miękką bawełnianą odzież,
- stosować emolienty do pielęgnacji, nawilżania
- i regeneracji skóry,
- myć zęby miękką szczoteczką,
- unikać alkoholowych preparatów do płukania ust,
- stosować na skórę krem z witaminą K,
- przy pierwszych oznakach suchej skóry rąk natłuszczać ją i zabezpieczać bawełnianymi rękawiczkami,
- prace domowe wykonywać w rękawiczkach ochronnych,
- smarować i zmiękczać suchą skórę rąk i stóp z tendencją do pękania wokół paznokci, na palcach i piętach kremami i żelami zawierającymi mocznik,
- obcinać paznokcie „na prosto”, nie wycinać skórek.
Mimo stosowania profilaktyki u części pacjentów pojawią się toksyczności skórne. Przy leczeniu powikłań skórnych, należy pamiętać o fundamentalnych zasadach wymienionych poniżej:
- Rozpocząć profilaktykę toksyczności skórnej od początku leczenia oraz utrzymać terapię miejscowej nawet po jego zakończeniu.
- Nie stosować miejscowych glikokortykosteroidów dłużej niż 14 dni.
- Stoso...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.