Infekcje skóry i gronkowiec złocisty
Spektrum kliniczne chorób bakteryjnych skóry jest zróżnicowane, a ich rozwój i przebieg zależy od właściwości patogenu, odporności komórkowej oraz humoralnej organizmu i obecności chorób współwystępujących [1]. Zakażenia bakteryjne skóry wywoływane są przez gronkowce (Staphylococcus), paciorkowce (Streptococcus), maczugowce (Corynebacterium), krętki (Spirochaeta), promieniowce (Actinomyces), prątki (Mycobacterium). W praktyce dermatologicznej najczęściej obserwuje się zakażenia wywołane przez gronkowce (zapalenie okołomieszkowe, figówka, czyrak), paciorkowce (róża) oraz zakażenia mieszane gronkowcowo-paciorkowcowe (liszajec zakaźny) [2, 3]. Poza pierwotnymi bakteryjnymi infekcjami skóry opisano i zdefiniowano wtórne nadkażenie bakteryjne skóry, tzw. zliszajcowacenie (impetiginisatio) [2, 4]. Zliszajcowacenie to powikłanie powstające na podłożu różnorodnych zmian chorobowych, głównie wysiękowych i swędzących, najczęściej wywoływane przez bakterie Staphylococcus areus lub Streptococcus pyogenes [3, 4]. Klinicznie manifestuje się ono powstaniem miękkich, miodowożółtych strupów charakterystycznych też dla liszajca zakaźnego [3, 4]. Zliszajcowacenie rozwija się na wcześniej zmienionej chorobowo skórze w przebiegu: infekcji wirusowych (herpes simplex), pasożytniczych (świerzb), grzybic skóry, chorób zapalnych, takich jak atopowe zapalenie skóry, kontaktowe zapalenie skóry, łuszczyca [2, 3].
W Stanach Zjednoczonych oszacowano, że infekcje skóry są powodem ponad 14 mln wizyt ambulatoryjnych rocznie, a liczba wizyt wynosi ponad 400 na 10 tys. osób rocznie [5]. Ponad 11 mln zakażeń skóry i tkanek miękkich jest wywołanych przez gronkowca złocistego [6]. Bakteria ta produkuje różne toksyny, w zależności od szczepu. Enterotoksyny są superantygenami zdolnymi do ominięcia aktywnych mechanizmów nadzoru immunologicznego i aktywowania w sposób niespecyficzny limfocytów T. Powodują masowe uwalnianie cytokin, prowadząc do aktywacji i podtrzymania odpowiedzi zapalnej w skórze [7]. Cytotoksyna PVL (panton valentine leukocidin) to toksyna odpowiedzialnych za zwiększoną zjadliwość metycylinoopornych szczepów S. aureus. Powoduje ona zniszczenie leukocytów i martwicę tkanek poprzez pobudzenie czynników chemotaktycznych (IL-8, leukotrienów) [7]. Przez produkowane toksyny gronkowiec złocisty może być przyczyną niepowodzenia oraz oporności na terapię miejscowymi glikokortykosteroidami (mGKS) [8, 9]. Bierze on także udział w jednym z mechanizmów powstawania świądu związanym z aktywnością IL-31 [10].
POLECAMY
Wybrane choroby zapalne sprzyjające nadkażeniom bakteryjnym
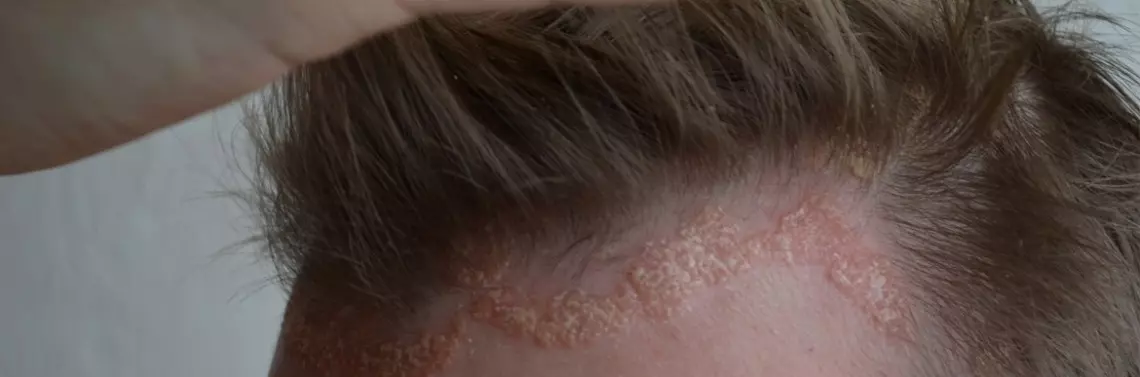
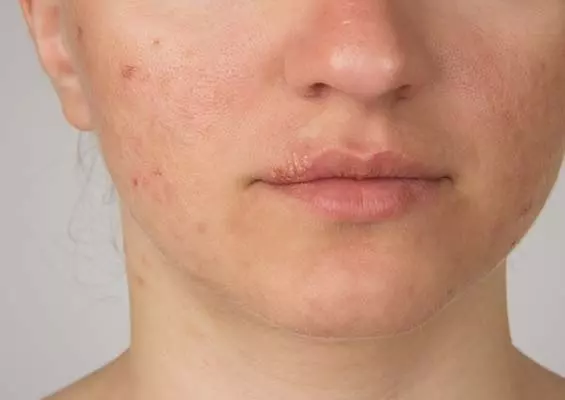
Atopowe zapalenie skóry
Atopowe zapalenie skóry (AZS, wyprysk atopowy) jest częstą przewleką chorobą skóry o podłożu zapalnym ze współwystępującym defektem bariery naskórkowej, charakteryzującą się zburzeniami równowagi mikrobiomu skóry, a w związku z powyższymi tendencją do nadkażeń bakteryjnych. Atopowe zapalenie skóry występuje u ok. 20% dzieci oraz 5% dorosłych [11], a skóra pacjentów z AZS skolonizowana jest przez gronkowca złocistego w 90% przypadków [12]. Kryteria rozpoznania AZS zostały opracowane przez Hanifina i Rajkę w 1980 r. i jednym z nich są nawracające infekcje skórne [13]. Obraz kliniczny, a przede wszystkim towarzyszący chorobie uporczywy świąd i zaburzenia snu, negatywnie wpływają na jakość życia pacjentów, ich rodzin, relacje społeczne i bilans ekonomiczny [14, 15]. Stąd powszechne jest oczekiwanie skutecznego, zoptymalizowanego i spersonalizowanego leczenia choroby. Pomocne w osiągnięciu tego celu jest poznanie i zrozumienie złożonej patogenezy AZS, która obejmuje cztery obszary: genetykę, immunologię, defekt bariery naskórkowej i mikrobiom [16]. Zaburzenia genetyczne w AZS dotyczą genów kodujących białka strukturalne i funkcjonalne naskórka (gen filagryny – FLG), białka odgrywające rolę w regulacji wrodzonej i nabytej odpowiedzi immunologicznej [16]. Nieprawidłowości immunologiczne wynikają z nieprawidłowej aktywności komórek Langerhansa, nadmiernej aktywacji układu Th2-komórkowego (IL-4, IL-13, IL-31
z nadprodukcją IgE), Th17- i Th22- komórkowego z odpowiednią pulą cytokin od nich zależnych (IL-17, IL-22) [17]. W wywołaniu ostrego i podtrzymaniu...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.