Epidemiologia i etiologia
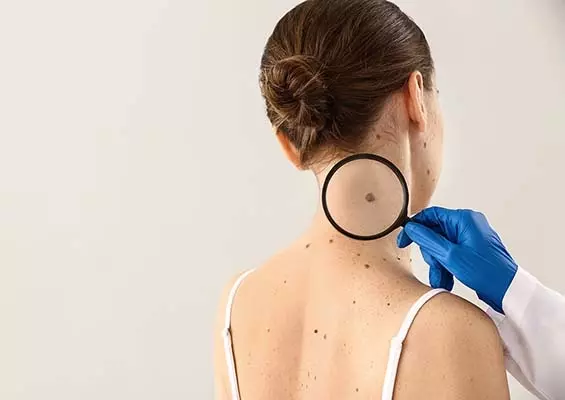
Czerniaki skóry są złośliwymi nowotworami wywodzącymi się z neuroektodermalnych komórek melanocytarnych. W ich powstawaniu najistotniejsze znaczenie ma intensywne działanie promieniowania ultrafioletowego naturalnego i sztucznego, stałe drażnienie mechaniczne lub chemiczne oraz predyspozycje osobnicze związane z niską zawartością barwnika w skórze i uwarunkowaniami genetycznymi [1, 2]. Ryzyko zachorowania na czerniaka skóry wzrasta wraz z wiekiem, a najwięcej przypadków u obu płci – ponad jedną trzecią – notuje się pomiędzy 50. a 64. rokiem życia.
Polska należy do krajów o średniej częstości występowania czerniaka, jednak w odniesieniu do ogólnej liczby zachorowań na nowotwory złośliwe czerniaki skóry występują w Polsce względnie rzadko. W 2018 r. w Krajowym Rejestrze Nowotworów (KRN) odnotowano niemal 167 500 zachorowań na nowotwory złośliwe
i 101 400 zgonów z ich powodu, w tym czerniaka skóry rozpoznano u 1736 mężczyzn (2,1%) i u 1962 kobiet (2,3%). Standaryzowane współczynniki umieralności w 2018 r. osiągnęły wartości ok. 2,29 na 100 000 u mężczyzn i 1,3 na 100 000 u kobiet, co odpowiadało ok. 800 zgonom z powodu czerniaka u mężczyzn
i 665 u kobiet. Czerniaki są jednak nowotworami charakteryzującymi się bardzo dużą dynamiką wzrostu zachorowań. Jak wynika z danych KRN, liczba rejestrowanych rocznie przypadków pomiędzy 2000 a 2018 r. wzrosła o blisko 1000 zarówno u mężczyzn, jak i u kobiet, co odpowiada podwojeniu liczby rocznych zachorowań w tym okresie [3–5].
Ze względu na lokalizację zdecydowana większość przypadków – ok. 80% – jest rozpoznawana na wczesnym, miejscowym etapie zaawansowania, co po wdrożeniu odpowiedniego leczenia pozwala na uzyskanie ok. 70–95% przeżyć pięcioletnich. Stadium zaawansowania regionalnego i uogólnienia w momencie rozpoznania czerniaka skóry stwierdza się odpowiednio u blisko 15% i 5% chorych [1].
POLECAMY
Diagnostyka i leczenie chirurgiczne
Odpowiednie postępowanie diagnostyczno-lecznicze ma bardzo istotne znaczenie, dlatego zaleca się, aby było prowadzone w ramach posiadających doświadczenie, wielodyscyplinarnych zespołów. Podstawą rozpoznania czerniaków skóry jest histopatologiczne badanie całej wyciętej chirurgicznie zmiany (mikrostopniowanie I), którą usuwa się z marginesem bocznym 1–2 mm niezmienionej chorobowo skóry. Taka biopsja wycinająca pozwala na uzyskanie wiarygodnych informacji o zmianie pierwotnej, które są niezbędne do ustale...

Dołącz do grona specjalistów, którzy stale pogłębiają swoją wiedzę
Co trzy miesiące otrzymuj sprawdzone narzędzie i artykuły tworzone przez ekspertów-praktyków. Pogłębiaj wiedzę, pracuj sprawniej i bądź przygotowany na najbardziej skomplikowane przypadki.