R e k l a m a
Łysienie androgenowe
Łysienie androgenowe jest jedną z najczęstszych przyczyn łysienia zarówno u mężczyzn, jak i u kobiet. Cechą charakterystyczną jest szczególny wzór utraty włosów, który dotyczy okolic czołowej, wierzchołkowej i ciemieniowych, z oszczędzeniem okolicy potylicznej.
U mężczyzn łysienie androgenowe może przebiegać z przesunięciem się linii owłosienia do tyłu (typ M, jeżeli przesunięcie linii dotyczy okolic czołowo-skroniowych; typ C, jeżeli przesunięcie dotyczy całej linii czołowej) [1–4] i/lub z przerzedzeniem się włosów w okolicy wierzchołkowej (zdj. 1). Tradycyjnie nasilenie łysienia androgenowego u mężczyzn można oceniać w skali Hamiltona–Norwooda [5].

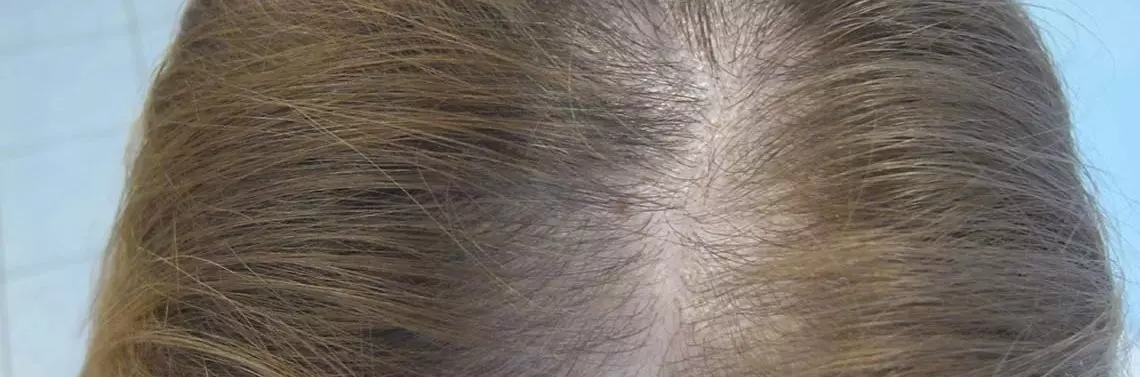
Łysienie androgenowe u kobiet ma nieco odmienny przebieg kliniczny – linia włosów jest zachowana, najczęstszym objawem jest przerzedzanie się włosów w okolicach czołowej i wierzchołkowej. Stopień utraty włosów klasyfikujemy w trzypunktowej skali Ludwiga [6] lub w pięciostopniowej skali Sinclair'a [7]. U niektórych pacjentek jedynym objawem jest objaw szerokiego przedziałka, co zostało opisane przez Olsen i wsp. (zdj. 2) [8].

Patogeneza łysienia androgenowego
Patogeneza łysienia androgenowego to przede wszystkim genetycznie uwarunkowana predyspozycja mieszków włosowych zlokalizowanych w okolicy czołowej i wierzchołkowej do stopniowej miniaturyzacji [9–11]. Ten proces jest mediowany przez dihydroepiandrostendion (DHT), aczkolwiek nie jest zależny od wysokiego stężenia tego hormonu w surowicy. Mieszki włosowe w okolicach predysponowanych wykazują wyższą aktywność 5-alfa-reduktazy i mniejszą aromatazy niż mieszki włosowe okolicy potylicznej. Różnice te wynikają najprawdopodobniej z innego pochodzenia embriogenetycznego ww. okolic owłosionej skóry głowy [12].
W predysponowanych mieszkach włosowych skraca się faza wzrostu włosa (anagen), dodatkowo okresowo dochodzi do synchronizacji cyklu włosowego, w związku z czym niektórzy pacjenci mogą zaobserwować wzmożone wypadanie włosów [13].
Głównym problemem klinicznym w łysieniu androgenowym jest stopniowo postępujące przerzedzanie się włosów. Oprócz tego, że następuje stopniowa miniaturyzacja mieszków włosowych, procesem, który odpowiada za ten obraz kliniczny, jest wchodzenie mieszków włosowych w fazę kenogenu. Jest to faza spoczynku mieszka włosowego, podczas której przez dłuższy czas nie produkuje on łodygi włosa (w prawidłowym cyklu włosowym zaraz po wypadnięciu włosa telogenowego mieszek włosowy wchodzi w nowy anagen i produkuje nową łodygę włosa) [14].
Trichoskopia w łysieniu androgenowym
Obecnie trichoskopia jest podstawową metodą służącą do diagnostyki łysienia. Objawy trichoskopowe często odzwierciedlają procesy patogenetyczne i w przypadku łysienia androgenowego stopniowa miniaturyzacja mieszków włosowych odpowiada obserwowanej heterogeniczności grubości łodyg włosowych i zwiększonemu odsetkowi włosów meszkowych (więcej niż 10%) [15]. Zwiększony odsetek mieszków włosowych w fazie kenogenu w obrazach trichoskopowych przekłada się na obecność rozsianych żółtych kropek (puste ujścia mieszków włosowych wypełnione łojem i keratyną) i redukcję liczby włosów w jednostkach włosowych. U zdrowych osób jednostki włosowe w trichoskopii są zbudowane z dwóch lub trzech łodyg (średnio 2,6) [15]. W łysieniu androgenowym odsetek jednostek włosowych z trzema łodygami początkowo ulega redukcji, a w zaawansowanych stadiach choroby dominują już jednostki włosowe z jedną łodygą (zdj. 3) [15, 16].

U części pacjentów w badaniu histopatologicznym w górnych częściach mieszków włosowych są obecne miernie nasilone nacieki limfocytarne, a ich obecność negatywnie koreluje z odpowiedzią na leczenie [17, 18]. Ten proces w obrazowaniu trichoskopowym jest widoczny jako brązowe przebarwienia okołomieszkowe [15], co może mieć swoje dalsze implikacje terapeutyczne, o czym będzie mowa w dalszej części artykułu.
Leczenie łysienia androgenowego
Każdy pacjent powinien zostać poinformowany, że pierwszym celem terapeutycznym jest zatrzymanie procesu łysienia, aczkolwiek w większości przypadków możliwe jest uzyskanie częściowej poprawy.
Minoksydyl
Minoksydyl jest od dawna stosowany w terapii miejscowej jako roztwór 2- lub 5-proc. Mechanizm działania nie jest do końca znany, pod uwagę brany jest efekt wazodylatacyjny. Efekty terapeutyczne pod postacią większej gęstości włosów mogą być zaobserwowane najszybciej po sześciu miesiącach terapii. Przejściowym efektem niepożądanym jest łysienie telogenowe w mechanizmie nagłego uwolnienia telogenu, które rozpoczyna się po kilku tygodniach od rozpoczęcia terapii i ustępuje najczęściej w ciągu kilku następnych tygodni [19]. Inne objawy niepożądane to świąd i podrażnienie miejscowe, które często są związane nie z samym minoksydylem, lecz z glikolem propylenowym, który jest obecny w preparatach dostępnych w Polsce (w Polsce nie jest dostępny preparat minoksydylu w postaci pianki).
U kobiet problematycznym działaniem niepożądanym może być też hipertrichoza twarzy. Aby jej zapobiec, zaleca się używanie preparatu na co najmniej cztery godziny przed snem.
Obawę pacjentów budzi utrata efektu po odstawieniu leczenia. Zwykle wzmożone wypadanie włosów jest obserwowane po trzech miesiącach, a powrót do stanu sprzed leczenia – po sześciu miesiącach od zakończenia terapii. Dlatego należy poinformować pacjentów, że łysienie androgenowe to choroba przewlekła, a leczenie jest długotrwałe [19–22].
Ostatnie lata to powrót do leczenia minoksydylem doustnie, jednakże dawki leku są istotnie mniejsze (0,00025–0,005 g) niż zarejestrowane kilkadziesiąt lat temu do leczenia nadciśnienia tętniczego. Efekty terapeutyczne wydają się znamiennie lepsze niż przy terapii miejscowej.
Działania niepożądane terapii nie są często obserwowane. Zalicza się do nich objawy hipotensji, zaburzenia rytmu serca, hipertrichozę (zależną od dawki leku) oraz pokrzywkę. Należy pamiętać o konieczności skutecznej antykoncepcji u pacjentek w wieku rozrodczym [1, 3, 23, 24].
W Polsce nie jest dostępny preparat gotowy, można zlecić lek recepturowy.
Spironolakton
Jeden z najczęściej stosowanych leków antyandrogenowych w leczeniu łysienia typu kobiecego, nie ma jednak rejestracji w tym wskazaniu i nadal istnieje konieczność potwierdzenia jego skuteczności w randomizowanych badaniach klinicznych. Działa przede wszystkim poprzez kompetycyjne blokowanie receptora androgenowego w tkankach docelowych (w mieszku włosowym), a stosowane dawki wahają się od 25 do 200 mg/dobę (osobiste preferencje autorki to niskie dawki leku).
Spironolakton jest diuretykiem oszczędzającym potas. Działania niepożądane dotyczą możliwych zaburzeń elektrolitowych (dawkozależne), hipotensji i efektu moczopędnego. Kobiety w wieku rozrodczym muszą stosować skuteczną antykoncepcję. Lek nie jest stosowany u mężczyzn ze względu na możliwą ginekomastię [23, 25–28].
Finasteryd
Finasteryd (inhibitor 5-alfa-reduktazy I) w dawce 1 mg jest zarejestrowany do leczenia łysienia androgenowego mężczyzn. U kobiet jest stosowany w dawkach 2,5–5 mg pozarejestracyjnie (wykazano, że dawka 1 mg nie przynosi korzyści u kobiet) [29, 30].
Finasteryd w leczeniu łysienia androgenowego mężczyzn daje najlepsze efekty, kiedy rozpocznie się leczenie przy mniejszym zaawansowaniu choroby i w grupie mężczyzn w wieku od 30. [31] do 40. roku życia [32]. Maksymalny efekt obserwuje się zazwyczaj po dwóch latach terapii. Wydaje się, że leczenie będzie nieskuteczne, jeżeli nie widać poprawy po 12 miesiącach leczenia [33], jednakże w jednym badaniu wykazano, że w tej grupie pacjentów poprawa może być obserwowana dużo później [31].
Działania niepożądane finasterydu obejmują przede wszystkim zaburzenia w sferze seksualnej (obniżone libido, problemy ze wzwodem, mniejsza ilość nasienia), jednakże badania wykazały, że w porównaniu z grupą placebo będzie je odczuwać ok. 1–2% mężczyzn [31, 34, 35]. Nie wykazano, żeby finasteryd powodował zaburzenia płodności, [36] i nadal istnieją kontrowersje co do tego, czy może nasilić już istniejące [37]. Należy pamiętać, że finasteryd obniża stężenie PSA w surowicy, co może utrudnić diagnostykę urologiczną w kierunku łagodnego rozrostu prostaty lub raka prostaty.
Finasteryd u kobiet może być stosowany, jeżeli równocześnie jest stosowana skuteczna antykoncepcja (lek kategorii X w ciąży według FDA) lub u kobiet w wieku postmenopauzalnym. Im młodsza pacjentka i mniejsze nasilenie objawów choroby, tym lepsze efekty terapeutyczne. Niektóre badania pokazują, że najlepsze efekty terapeutyczne są uzyskiwane u kobiet poniżej 60. roku życia, a kobiety po 70. roku życia nie mają ich wcale [30].
Działania niepożądane nie są częste. Są to: bóle głowy, zaburzenia miesiączkowania, bóle piersi, zawroty głowy lub bardzo rzadko hipertrichoza [29, 38].
Obecnie prowadzone badania wskazują na skuteczność terapii miejscowej finasterydem i lepszy profil bezpieczeństwa w porównaniu do terapii ogólnej [20, 39]. Gotowy preparat do leczenia miejscowego jest jeszcze niedostępny.
Dutasteryd
Dutasteryd jest inhibitorem zarówno 5-alfa-reduktazy typu I, jak i 5-alfa-reduktazy typ II, w związku z czym wydaje się skuteczniejszy niż finasteryd, co wykazano w badaniach porównujących obie substancje [40]. W dawce 0,5 mg jest zarejestrowany do leczenia łagodnego przerostu prostaty, do leczenia łysienia androgenowego mężczyzn tylko w Korei. Wykazano, że jest skuteczniejszy niż finasteryd w odwracaniu objawów miniaturyzacji mieszków włosowych, ale przede wszystkim w okolicy czołowej (bez różnicy w łysieniu okolicy wierzchołkowej) [41], oraz że może być skuteczny u mężczyzn bez dobrej odpowiedzi na terapię finasterydem [42].
Objawy niepożądane są podobne do tych obserwowanych u pacjentów leczonych finasterydem, ale występują dużo częściej (kilkanaście procent pacjentów) [40, 42].
Kobiety mogą być leczone dutasterydem pozarejestracyjnie, należy jednak pamiętać, że skuteczna antykoncepcja jest konieczna jeszcze przez sześć miesięcy po zakończeniu terapii. Efekty terapeutyczne są najlepsze u kobiet poniżej 50. roku życia [43].
W niektórych krajach dutasteryd jest dostępny do podawania doogniskowego (w mezoterapii) [44], jednakże nie ma badań porównujących efektywność tej metody do terapii ogólnej.
Leczenie chirurgiczne łysienia androgenowego
Leczenie to polega przede wszystkim na przeszczepie włosów. Obecnie najczęściej stosowane są metody mikrochirurgiczne, polegające na pobraniu jednostki włosowo- łojowej z okolicy dawczej, którą jest niewrażliwa na androgeny okolica potyliczna, i przeniesieniu ich w okolicę biorczą [45]. Należy jednak pamiętać, że bez właściwie prowadzonego leczenia podstawowego efekty metod chirurgicznych mogą być dla pacjenta rozczarowujące, przede wszystkim ze względu na postępujący charakter choroby.
Inne metody stosowane w leczeniu łysienia androgenowego
W 2007 r. FDA potwierdziła bezpieczeństwo stosowania urządzenia o nazwie HairMax LaserComb (Lexington International LLC, Boca Raton, FL, USA) emitującego promienie o długości 650 nm. Metoda może być bezpiecznie stosowana przez kobiety w ciąży i kobiety karmiące, jednakże konieczne są dalsze badania potwierdzające jej skuteczność [46].
Jako metodę dodatkową w leczeniu łysienia androgenowego mężczyzn i kobiet można stosować osocze bogatopłytkowe podawane doogniskowo. Nie ma konsensusu dotyczącego najlepszego stężenia płytek w surowicy, częstości podawania osocza oraz najlepszej metody jego uzyskiwania. Terapia wydaje się bezpieczna i co najmniej kilkanaście badań wskazuje na jej skuteczność w leczeniu wspomagającym łysienia androgenowego zarówno mężczyzn, jak i kobiet [47–52].
Wydaje się, że pacjenci, u których występuje mikrozapalenie okołomieszkowe (stwierdzone w badaniu histopatologicznym lub w trichoskopii obecny objaw okołomieszkowy), powinni być dodatkowo leczeni miejscową kortykosteroidoterapią. Polskie Towarzystwo Dermatologiczne rekomenduje miejscowy roztwór z klobetazolem stosowany raz–dwa razy w tygodniu przez przynajmniej sześć miesięcy [53].
Analogi prostaglandyny F (latanoprost i bimatoprost) mogą działać w łysieniu androgenowym poprzez indukcję fazy anagenu w mieszku włosa telogenowego [54]. Obecnie są dostępne wyłącznie w postaci kropli do oczu (zarejestrowane do leczenia jaskry).
Do leczenia łysienia androgenowego nie są zalecane preparaty z estrogenami ze względu na brak badań potwierdzających ich skuteczność. Istnieją wyłącznie doniesienia kazuistyczne [53].
Podsumowanie
Łysienie androgenowe jest przewlekłą chorobą uwarunkowaną genetycznie i dotyczy zarówno mężczyzn, jak i kobiet. Celem leczenia jest przede wszystkim zahamowanie postępu choroby. W leczeniu stosuje się minoksydyl miejscowo i ogólnie, spironolakton, finasteryd, dutasteryd, osocze bogatopłytkowe, niskoenergetyczną laseroterapię i leczenie chirurgiczne. Większość uznanych przez środowisko dermatologiczne metod terapeutycznych jest stosowana poza wskazaniami rejestracyjnymi. W celu uzyskania najlepszego efektu stosuje się kilka metod jednoczasowo.
Piśmiennictwo
- Beach R.A., McDonald K.A., Barrett B.M. Tolerated, effective, successful: low dose oral minoxidil for treating alopecia, a 3-year North American retrospective case series. J Am Acad Dermatol 2020; S0190-9622(20)32844-9.
- Pirmez R., Salas-Callo C.I. Very-low-dose oral minoxidil in male androgenetic alopecia: A study with quantitative trichoscopic documentation. J Am Acad Dermatol 2020; 82 (1): e21–e22.
- Vano-Galvan S., Pirmez R., Hermosa-Gelbard A. et al. Safety of low-dose oral minoxidil for hair loss: A multicenter study of 1404 patients. J Am Acad Dermatol 2021; 84 (6): 1644–1651.
- Lee W.S., Ro B.I., Hong S.P. et al. A new classification of pattern hair loss that is universal for men and women: basic and specific (BASP) classification. J Am Acad Dermatol 2007; 57 (1): 37–46.
- Norwood O.T. Male pattern baldness: classification and incidence. South Med J 1975; 68 (11): 1359–1365.
- Ludwig E. Classification of the types of androgenetic alopecia (common baldness) occurring in the female sex. Br J Dermatol 1977; 97 (3): 247–254.
- Kerkemeyer K.L., Poa J.E., Trindade de Carvalho L. et al. Development and initial validation of a modified Sinclair scale for female pattern hair loss in men. J Am Acad Dermatol 2022; 86 (6): 1406–1408.
- Olsen E.A. The midline part: an important physical clue to the clinical diagnosis of androgenetic alopecia in women. J Am Acad Dermatol 1999; 40 (1): 106–109.
- Nyholt D.R., Gillespie N.A., Heath A.C. et al. Genetic basis of male pattern baldness. J Invest Dermatol 2003; 121 (6): 1561–1564.
- Heilmann-Heimbach S., Hochfeld L.M., Paus R. et al. Hunting the genes in male-pattern alopecia: how important are they, how close are we and what will they tell us? Exp Dermatol 2016; 25 (4): 251–257.
- Whiting D.A. Possible mechanisms of miniaturization during androgenetic alopecia or pattern hair loss. J Am Acad Dermatol 2001; 45 (3 Suppl): S81–S86.
- Sawaya M.E., Price V.H. Different levels of 5alpha-reductase type I and II, aromatase, and androgen receptor in hair follicles of women and men with androgenetic alopecia. J Invest Dermatol 1997; 109 (3): 296–300.
- Rebora A., Guarrera M. Teloptosis and kenogen: two new concepts in human trichology. Arch Dermatol 2004; 140 (5): 619–620.
- Guarrera M., Rebora A. Kenogen in female androgenetic alopecia. A longitudinal study. Dermatology 2005; 210 (1): 18–20.
- Rakowska A., Slowinska M., Kowalska-Oledzka E. et al. Dermoscopy in female androgenic alopecia: method standardization and diagnostic criteria. Int J Trichology 2009; 1 (2): 123–130.
- Harries M., Tosti A., Bergfeld W. et al. Towards a consensus on how to diagnose and quantify female pattern hair loss – The ‘Female Pattern Hair Loss Severity Index (FPHL-SI)’. J Eur Acad Dermatol Venereol 2016; 30 (4): 667–676.
- Gheisari M., Hamidi A.B., Hamedani B. et al. Androgenetic alopecia; An attempt to target microinflammation. Dermatol Ther 2020; 33 (2): e13266.
- Mahe Y.F., Michelet J.F., Billoni N. et al. Androgenetic alopecia and microinflammation. Int J Dermatol 2000; 39 (8): 576–584.
- Gupta A.K., Talukder M., Venkataraman M. et al. Minoxidil: a comprehensive review. J Dermatolog Treat 2021: 1–11.
- Gupta A.K., Charrette A. Topical minoxidil: systematic review and meta-analysis of its efficacy in androgenetic alopecia. Skinmed 2015; 13 (3): 185–189.
- Gupta A.K., Foley K.A. 5% minoxidil: treatment for female pattern hair loss. Skin Therapy Lett 2014; 19 (6): 5–7.
- Ghonemy S., Alarawi A., Bessar H. Efficacy and safety of a new 10% topical minoxidil versus 5% topical minoxidil and placebo in the treatment of male androgenetic alopecia: a trichoscopic evaluation. J Dermatolog Treat 2021; 32 (2): 236–241.
- Sinclair R.D. Female pattern hair loss: a pilot study investigating combination therapy with low-dose oral minoxidil and spironolactone. Int J Dermatol 2018; 57 (1): 104–109.
- Rodrigues-Barata R., Moreno-Arrones O.M., Saceda-Corralo D. et al. Low-dose oral minoxidil for female pattern hair loss: a unicenter descriptive study of 148 women. Skin Appendage Disord 2020; 6 (3): 175–176.
- Hoedemaker C., van Egmond S., Sinclair R. Treatment of female pattern hair loss with a combination of spironolactone and minoxidil. Australas J Dermatol 2007; 48 (1): 43–45.
- Rathnayake D., Sinclair R. Innovative use of spironolactone as an antiandrogen in the treatment of female pattern hair loss. Dermatol Clin 2010; 28 (3): 611–618.
- Vargas-Mora P., Morgado-Carrasco D. Spironolactone in dermatology: uses in acne, hidradenitis suppurativa, female pattern baldness, and hirsutism. Actas Dermosifiliogr (Engl Ed) 2020; 111 (8): 639–649.
- Olamiju B., Craiglow B.G. Combination oral minoxidil and spironolactone for the treatment of androgenetic alopecia in adolescent girls. J Am Acad Dermatol 2021; 84 (6): 1689–1691.
- Won Y.Y., Lew B.L., Sim W.Y. Clinical efficacy of oral administration of finasteride at a dose of 2.5 mg/day in women with female pattern hair loss. Dermatol Ther 2018; 31 (2): e12588.
- Oliveira-Soares R., Correia M.P., Andre M.C. et al. Finasteride 5 mg/day treatment of patterned hair loss in normo-androgenetic postmenopausal women. Int J Trichology 2013; 5 (1): 22–25.
- Rossi A., Cantisani C., Scarno M. et al. Finasteride, 1 mg daily administration on male androgenetic alopecia in different age groups: 10-year follow-up. Dermatol Ther 2011; 24 (4): 455–461.
- Yoshitake T., Takeda A., Ohki K. et al. Five-year efficacy of finasteride in 801 Japanese men with androgenetic alopecia. J Dermatol 2015; 42 (7): 735–738.
- Whiting D.A., Olsen E.A., Savin R. et al. Efficacy and tolerability of finasteride 1 mg in men aged 41 to 60 years with male pattern hair loss. Eur J Dermatol 2003; 13 (2): 150–160.
- Mysore V. Finasteride and sexual side effects. Indian Dermatol Online J 2012; 3 (1): 62–65.
- Mysore V., Shashikumar B.M. Guidelines on the use of finasteride in androgenetic alopecia. Indian J Dermatol Venereol Leprol 2016; 82 (2): 128–134.
- Overstreet J.W., Fuh V.L., Gould J. et al. Chronic treatment with finasteride daily does not affect spermatogenesis or semen production in young men. J Urol 1999; 162 (4): 1295–1300.
- Lobo O.C., Mysore V. Is semen analysis necessary prior to initiation of finasteride treatment? Indian J Dermatol Venereol Leprol 2019; 85 (3): 310–311.
- Oliveira-Soares R., Andre M.C., Peres-Correia M. Adverse effects with finasteride 5 mg/day for patterned hair loss in premenopausal women. Int J Trichology 2018; 10 (1): 48–50.
- Piraccini B.M., Blume-Peytavi U., Scarci F. et al. Efficacy and safety of topical finasteride spray solution for male androgenetic alopecia: a phase III, randomized, controlled clinical trial. J Eur Acad Dermatol Venereol 2022; 36 (2): 286–294.
- Shanshanwal S.J., Dhurat R.S. Superiority of dutasteride over finasteride in hair regrowth and reversal of miniaturization in men with androgenetic alopecia: A randomized controlled open-label, evaluator-blinded study. Indian J Dermatol Venereol Leprol 2017; 83 (1): 47–54.
- Gubelin Harcha W., Barboza Martinez J., Tsai T.F. et al. A randomized, active- and placebo-controlled study of the efficacy and safety of different doses of dutasteride versus placebo and finasteride in the treatment of male subjects with androgenetic alopecia. J Am Acad Dermatol 2014; 70 (3): 489–498 e3.
- Jung J.Y., Yeon J.H., Choi J.W. et al. Effect of dutasteride 0.5 mg/d in men with androgenetic alopecia recalcitrant to finasteride. Int J Dermatol 2014; 53 (11): 1351–1357.
- Boersma I.H., Oranje A.P., Grimalt R. et al. The effectiveness of finasteride and dutasteride used for 3 years in women with androgenetic alopecia. Indian J Dermatol Venereol Leprol 2014; 80 (6): 521–525.
- Moftah N., Moftah N., Abd-Elaziz G. et al. Mesotherapy using dutasteride-containing preparation in treatment of female pattern hair loss: photographic, morphometric and ultrustructural evaluation. J Eur Acad Dermatol Venereol 2013; 27 (6): 686–693.
- Jimenez F., Alam M., Vogel J.E. et al. Hair transplantation: Basic overview. J Am Acad Dermatol 2021; 85 (4): 803–814.
- Pillai J.K., Mysore V. Role of low-level light therapy (LLLT) in androgenetic alopecia. J Cutan Aesthet Surg 2021; 14 (4): 385–391.
- Kramer M.E., Keaney T.C. Systematic review of platelet-rich plasma (PRP) preparation and composition for the treatment of androgenetic alopecia. J Cosmet Dermatol 2018; 17 (5): 666–671.
- Oth O., Stene J.J., Glineur R. et al. [Injection of PRP (Platelet-rich plasma) as a treatment for androgenetic alopecia: a systematic review of the literature]. Rev Med Brux 2018.
- Sasaki G.H. The effects of lower vs higher cell number of platelet-rich plasma (PRP) on hair density and diameter in androgenetic alopecia (AGA): a randomized, double-blinded, placebo, parallel-group half-scalp IRB-approved study. Aesthet Surg J 2021; 41 (11): NP1659-NP72.
- Ince B., Yildirim M.E.C., Dadaci M. et al. Comparison of the efficacy of homologous and autologous platelet-rich plasma (PRP) for treating androgenic alopecia. Aesthetic Plast Surg 2018; 42 (1): 297–303.
- Gressenberger P., Kopera D. [Platelet-rich plasma (PRP) for the treatment of androgenetic alopecia (AGA): a review of the current literature]. Hautarzt 2022; 73 (5): 353–357.
- Gentile P., Garcovich S. Autologous activated platelet-rich plasma (AA-PRP) and non-activated (A-PRP) in hair growth: a retrospective, blinded, randomized evaluation in androgenetic alopecia. Expert Opin Biol Ther 2020; 20 (3): 327–337.
- Brzezińska-Wcisło L., Rakowska A., Rudnicka L. et al. Androgenetic alopecia. Diagnostic and therapeutic recommendiations of the Polish Dermatological Society. Dermatol Rev 2018; 105: 1–18.
- Blume-Peytavi U., Lonnfors S., Hillmann K. et al. A randomized double-blind placebo-controlled pilot study to assess the efficacy of a 24-week topical treatment by latanoprost 0.1% on hair growth and pigmentation in healthy volunteers with androgenetic alopecia. J Am Acad Dermatol 2012; 66 (5): 794–800.